
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
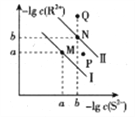
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 0.1 mol/L Na2SO3溶液,正确的是( )
A.升高温度,溶液 pH 降低
B.c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO![]() )+2c(HSO
)+2c(HSO![]() )+c(OH-)
)+c(OH-)
D.加入少量 NaOH 固体,c(SO![]() )与c(Na+)均增大
)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知次氯酸是比碳酸还弱的酸,反应Cl2 + H2O![]() HCl + HClO达平衡后,要使HClO浓度增大,可加入
HCl + HClO达平衡后,要使HClO浓度增大,可加入
A.足量6mol/L NaOH溶液 B.少量6mol/L H2SO4溶液
C.少量NaHCO3固体 D.足量Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙,甲是常见温室效应气体。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物,其转化关系如图所示。下列判断不正确的是
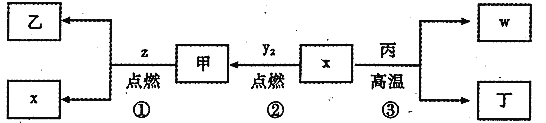
A.反应①②③都属于氧化还原反应B.X、Y、Z、W四种元素中,W的原子半径最大
C.在信息工业中,丙常作光导纤维材料D.一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。某温度下,将 2 mol SO2 和 1 mol O2 置于 10L 密闭容器中,反应达平衡后,SO2 的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g)ΔH<0。某温度下,将 2 mol SO2 和 1 mol O2 置于 10L 密闭容器中,反应达平衡后,SO2 的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
甲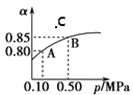 乙
乙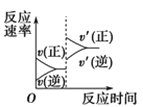 丙
丙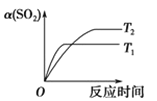
A.由图甲推断,B 点 SO3的平衡浓度为 0.3molL1
B.在图甲中,在此温度下,C 点 υ 正<υ 逆
C.达到平衡后,保持体积不变,充入氦气,压强增大,则反应速率变化图像可以用图乙表示
D.压强为 0.50 MPa 时,不同温度下 SO2 的平衡转化率与时间关系如图丙,则 T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是( )
A.铁触媒有利于合成氨反应
B.夏天开启啤酒瓶盖后,瓶中立刻泛起大量泡沫
C.对装有N2O4和NO2混合气体的密闭烧瓶加热,颜色变深
D.合成氨反应:![]()
![]()
![]() ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,说明该反应的△H<0
B. 加水稀释0.1mol·L-1的CH3COONa溶液后,溶液中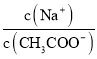 的值增大
的值增大
C. 氟元素的非金属性强于溴元素,由此可推出酸性:HF>HBr
D. 用等物质的量浓度的NaOH溶液中和等体积且pH均为2的盐酸和醋酸溶液,盐酸消耗的NaOH溶液体积更多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H-H键的键能为436kJ· mol-1,H-N键的键能为391 kJ· mol-1,根据热化学方程式:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
2NH3(g) △H=-92.4 kJ· mol-1,可知N≡N键的键能是
A.431 kJ· mol-1B.649 kJ· mol-1C.945.6 kJ· mol-1D.896 kJ· mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com