
| A. | NH3 | B. | 乙烯 | C. | 甲烷 | D. | 丙烯 |
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
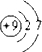 ,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号);
,五种元素原子半径从大到小的顺序是Na>Si>O>F>H (填元素符号); 、
、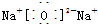 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.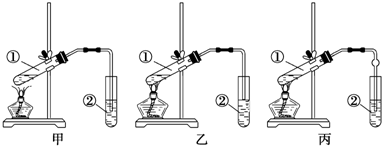
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 1 | C. | 0 | D. | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液 | B. | KSCN溶液 | C. | NaOH溶液 | D. | NH3•H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入过量氨水中:SO2+NH3•H2O=NH4++HSO3- | |
| B. | (CH3COO)2Ba溶液中滴入稀硫酸:Ba2++SO42-=BaSO4↓ | |
| C. | 以Ag作电极,电解AgNO3溶液:4Ag++2H2O=4Ag↓+O2↑+4H+ | |
| D. | AgCl悬浊液中加入Na2S溶液:2AgCl+S2-=Ag2S+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ||||
| 三 | ⑦ | ④ | ⑤ | ⑥ | |||
| 四 | ⑧ | ⑨ | ⑩ |
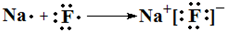 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com