
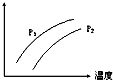
 如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )
如图表示温度、压强对达平衡的可逆反应:2L(g)?2M(g)+N(g)△H>0的影响(P1<P2)图中y轴表示的意义是( )| A. | 混合物中L的百分含量 | B. | 混合气体的密度 | ||
| C. | L的转化率 | D. | 混合气体的平均分子量 |
分析 由图可知,压强越大,Y的值的越小,温度越高,Y的值越大,而反应为气体体积增大的吸热反应,根据外界条件对平衡移动的影响答题.
解答 解:由图可知,压强越大,Y的值的越小,温度越高,Y的值越大,而反应为气体体积增大的吸热反应,则
A、压强增大,平衡逆向移动,L的百分含量增大,故A错误;
B、反应中密闭容器中,气体质量守恒,所以密度始终不变,故B错误;
C、压强增大,平衡逆向移动,L的转化率减小,升高温度平衡正向移动L的转化率增大,故C正确;
D、该反应气体质量守恒,压强增大,平衡逆向移动,总物质的量减小,平均相对分子质量增大,温度升高,平衡正向移动,总物质的量增大,平均相对分子质量减小,故D错误;
故选C.
点评 本题主要考查了外界条件对平衡移动的影响,中等难度,解题时注意图与反应的特征相结合.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 (1)实验室用如图所示装置制备少量乙酸乙酯.
(1)实验室用如图所示装置制备少量乙酸乙酯. .试回答:
.试回答: +2Na→
+2Na→ +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-可以大量共存 | |
| B. | 0.1mol•L-1氨水:K+、Na+、NO3-、AlO2-可以大量共存 | |
| C. | 向(CH3COO)2Ba溶液中加入硫酸发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| D. | 已知K${\;}_{{a}_{1}}$(H2CO3)>Ka(HClO)>K${\;}_{{a}_{2}}$(H2CO3),向NaClO溶液中通入少量的CO2,发生反应的离子方程式为:CO2+2ClO-+H2O═CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
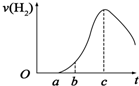 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间(单位:秒)的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加6.5g | B. | 减少6.5g | C. | 减少5.6g | D. | 增加6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | N2的电子式: | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com