
(16分)
(1)已知298K时,Fe(OH)3的溶度积常数![]() =2.6×10-39, Mg(OH)2的溶度积常数
=2.6×10-39, Mg(OH)2的溶度积常数![]() =5.6×
=5.6×![]() ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
有没有Mg(OH)2沉淀生成______________填“有”或“无”),理由是________________________________。
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市第二中学高二第一次月考化学试卷(带解析) 题型:计算题
(本题共10分)白磷、红磷是磷的两种同素异构体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足是生成P4O10。
(1)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=" -2983.2" kJ?mol-1,
P(s,红磷)+ 5/4O2(g)="1/4" P4O10(s) ΔH2=" -738.5" kJ?mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s) ΔH= -1638kJ?mol-1。在某密闭容器中加入62g白磷和50.4L氧气(标准状况下),控制条件使之恰好完全反应。则所得到的P4O10和P4O6的物质的量之比为 ,反应过程中放出的热量为为 。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下的化学键的键能(KJ/mol):P-P 198,Cl-Cl 243,P-Cl 331。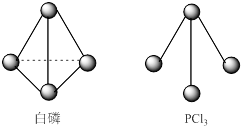
则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH = 。
查看答案和解析>>
科目:高中化学 来源:2014届江西省南昌市高二第一次月考化学试卷(解析版) 题型:计算题
(本题共10分)白磷、红磷是磷的两种同素异构体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足是生成P4O10。
(1)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)=P4O10(s) ΔH1= -2983.2 kJ•mol-1,
P(s,红磷)+ 5/4O2(g)=1/4 P4O10(s) ΔH2= -738.5 kJ•mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)=P4O6(s) ΔH= -1638kJ•mol-1。在某密闭容器中加入62g白磷和50.4L氧气(标准状况下),控制条件使之恰好完全反应。则所得到的P4O10和P4O6的物质的量之比为 ,反应过程中放出的热量为为 。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下的化学键的键能(KJ/mol):P-P 198,Cl-Cl 243,P-Cl 331。

则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热ΔH = 。
查看答案和解析>>
科目:高中化学 来源:2010-2011年福建安溪一中、惠安一中、养正中学高二上学期期末联考化学卷 题型:填空题
(16分)
(1)已知298K时,Fe(OH)3的溶度积常数 =2.6×10-39, Mg(OH)2的溶度积常数
=2.6×10-39, Mg(OH)2的溶度积常数 =5.6×
=5.6× ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
有没有Mg(OH)2沉淀生成______________填“有”或“无”),理由是________________________________。
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:
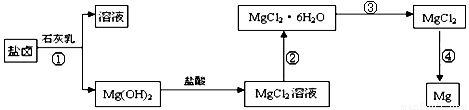
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
I.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中。
发生反应:2A(g)+B(g)![]() 2C(g)。反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为________________;
2C(g)。反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为________________;
该条件下反应的平衡常数为_______________________________。
|
|

|
|
|
|
|
Ⅱ.(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ。写出该反应的化学方程式__________________________________________.
 (20利用该反应设计一个燃料电池:用氢氧化钾溶液做电解 质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式____________________________
(20利用该反应设计一个燃料电池:用氢氧化钾溶液做电解 质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式____________________________
![]() (3)有如右化学实验装置图,
(3)有如右化学实验装置图,
石墨棒上的电极反应式为_______________________________;
如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃)(CuSO4 足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),可向溶液中加入________(填物质名称),其质量为_______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com