
下列叙述正确的是
A.使用催化剂能够降低化学反应的反应热(ΔH)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.SO2的水溶液能够导电,所以SO2是电解质
D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
科目:高中化学 来源:2015-2016学年广东省汕头市高一下期末化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.水分子的比例模型:
B.F-的结构示意图:
C.CO2的结构式:O-C-O
D.中子数为8的碳原子:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期末化学试卷(解析版) 题型:选择题
下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④ C.③①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:实验题
苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。
反应原理:
实验步骤:
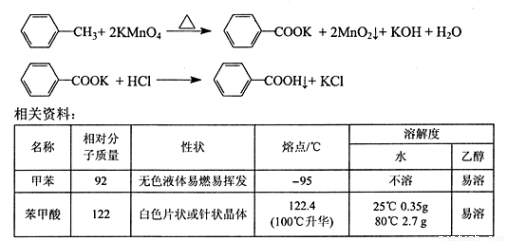
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/ mL)。

②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)仪器a名称为 。
(2)判断甲苯己完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52 mL.V3= 23.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点的现象是 。
③产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省五市十校教研教改共同体高二下期末化学试卷(解析版) 题型:选择题
将0.1mol/L醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(OH-)和c(H+)都减小
B.溶液的PH增大
C.醋酸电离平衡向左移动
D.溶液中c(H+)增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省、黄陂一中高二下期末化学试卷(解析版) 题型:实验题
以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
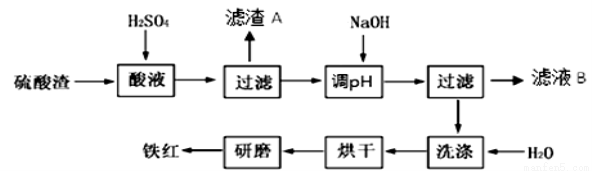
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: 。
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 。
(4)如何证明洗涤环节充分洗净 。
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 。(用题中所给数据计算并用最简整数比表示结果)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省、黄陂一中高二下期末化学试卷(解析版) 题型:选择题
下列各项操作中不发生先沉淀后溶解现象的是( )
①向饱和碳酸钠溶液中通人过量的CO2
②向Fe(OH)3胶体中逐滴滴加人过量H2SO4
③向Ba(NO)3溶液中通人过量SO2
④向石灰水中通人过量CO2
⑤向AlCl3溶液中逐滴滴加NaOH溶液至过量
A.①②③ B.①②⑤ C.①②③⑤ D.①③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期末化学试卷(解析版) 题型:填空题
(1)将1.0 mol CH4和2.0molH2O(g)通入容积固定为10 L的反应容器中,在一定条件下发生反应:CH4(g)+H2O(g)  CO (g)+3H2(g) ,测得在一定的压强下CH4的转化率与温度的关系如图1。
CO (g)+3H2(g) ,测得在一定的压强下CH4的转化率与温度的关系如图1。
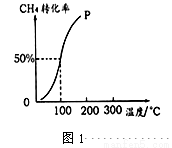
①该反应的ΔH 0(填“>”“<”或“=”)
②假设100 ℃时达到平衡所需的时间为3 min,则用H2表示该反应的平均反应速率为 mol/(L·min)。
③100℃时该反应的平衡常数的数值为 。
④可用来判断该反应达到平衡状态的标志有 (填字母)。
A.CO的含量保持不变
B.CH4浓度与CO浓度相等
C.ν正(CH4)=3ν逆(H2)
D.混合气体的密度保持不变
E.混合气体的总物质的量保持不变
F.混合气体的压强度保持不变
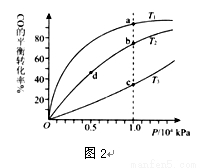
(2)生成甲醇的反应:CO(g)+2H2(g) CH3OH(g) △H =—129.0 kJ/mol,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是 (填字母)。
CH3OH(g) △H =—129.0 kJ/mol,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是 (填字母)。
A.温度:T1>T2 > T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a)>K(c) ; K(b)=K(d)
D.平均摩尔质量:M(a) >M(c); M(b)>M(d)
(3)工业上利用甲醇制备氢气的常用方法之一为:甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)  CO(g)+2H2(g),此反应能自发进行的原因是 。
CO(g)+2H2(g),此反应能自发进行的原因是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:选择题
将 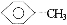 和C3H5(OH)3(甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是( )
和C3H5(OH)3(甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是( )
A.40% B.35% C.30% D.无法计算
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com