
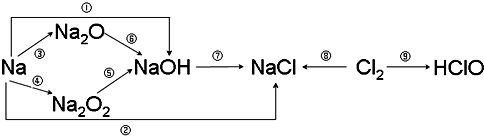
分析 (1)钠与水反应生成氢氧化钠和氢气;过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(2)氧化还原反应必须有化合价变化;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)氯水中含有氯离子和次氯酸分子.
解答 解:(1)钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2Na++2OH-+H2↑;过氧化钠与二氧化碳反应生成碳酸钠和氧气,化学方程式:2Na2O2+2CO2=2Na2CO3+O2;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Na2O2+2CO2=2Na2CO3+O2;
(2)①钠与水反应生成氢氧化钠和氢气、②钠与盐酸反应生成氯化钠、③钠与氧气反应生成氧化钠、④钠与氧气反应生成过氧化钠、⑤过氧化钠与水反应生成氢氧化钠、⑦氢氧化钠和氯气反应生成氯化钠、次氯酸和水、⑧氯气与钠反应生成氯化钠、⑨氯气与水反应生成盐酸和次氯酸,都有化合价变化,属于氧化还原反应;
⑥氧化钠为碱性氧化物,与水化合生成氢氧化钠,属于化合反应,但是无化合价变化,不是氧化还原反应,
故选:⑥;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)氯水中含有氯离子和次氯酸分子,氯离子能够与硝酸银反应生成氯化银沉淀,离子方程式:Ag++Cl-=AgCl↓;次氯酸具有漂白性,能够使有色布条褪色;
故答案为:Ag++Cl-=AgCl↓;红色褪去.
点评 本题考查了钠及其化合物之间的转化,明确物质的性质是解题关键,注意氯水的成分及性质,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分别将它们配制成溶液,再加入澄清石灰水 | |
| B. | 分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸 | |
| C. | 分别将它们配制成溶液,再加入CaCl2溶液 | |
| D. | 分别加热,再用石灰水检验是否有CO2产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
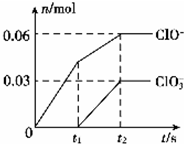 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与 反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A. | 反应中转移电子的物质的量是0.21mol | |
| B. | ClO3-的生成可能是由于温度升高引起的 | |
| C. | 苛性钾溶液中KOH的质量是16.8g | |
| D. | 一定有3.36L氯气参加反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 灼烧白色粉末,直接观察火焰颜色 | 火焰呈黄色 | 原粉末中有Na+无K+ |
| B | 将一块Al箔在酒精灯火焰上灼烧 | Al箔熔融而不滴落 | Al2O3具有较高的熔点 |
| C | 将一小块Na放入硫酸铜溶液中 | 有铜单质析出 | Na能置换出硫酸铜中的铜 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往NaHC2O4溶液中通入氨气至中性:c(H2C2O4)+c(NH4+)>c(C2O42-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/c(H+)变小 | |
| C. | 常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后过滤,所得滤液中存在:c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| D. | 在同浓度的HCN和NaCN的混合溶液中,若pH>7,则c(HCN)<c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com