
| A. | 单质的熔点、沸点高低 | |
| B. | 非金属之间发生的置换反应 | |
| C. | 非金属与氢气生成气态氢化物的难易程度 | |
| D. | 非金属元素的最高价氧化物的水化物的酸性强弱 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种黄绿色、有毒的气体 | |
| B. | 氯气的密度比空气的小 | |
| C. | 氯气不能溶于水,可以用排水法收集 | |
| D. | 氯气、氯水和液氯是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向澄清石灰水中加入少许NaOH固体,溶液不出现浑浊 | |
| B. | 向饱和Na2CO3溶液中通入CO2气体,一定有浑浊 | |
| C. | 向大量饱和CuSO4溶液中加入16gCuSO4,保持温度不变,析出晶体质量25g | |
| D. | 大量MnO2与含4mol HCl的浓盐酸共热,充分反应后生成Cl2的物质的量小于1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
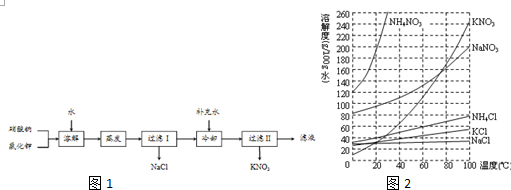
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4O和C2H4O2 | B. | C8H10和C4H10 | C. | C2H4和C2H4O | D. | C8H8和C4H8O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
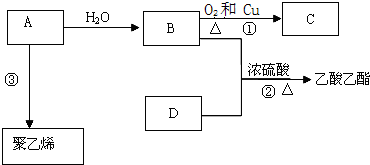
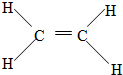 .
.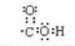 ;
;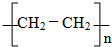 反应类型:加聚反应.
反应类型:加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{b}$=$\frac{1}{4}$ | B. | $\frac{a}{b}$=$\frac{3}{8}$ | C. | $\frac{1}{4}$≤$\frac{a}{b}$≤$\frac{3}{8}$ | D. | $\frac{a}{b}$的值无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET).国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口.以PX为主要原料生产PET的一种路线如图1:
对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET).国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口.以PX为主要原料生产PET的一种路线如图1: .(不用注明条件)
.(不用注明条件) .(不用注明条件)
.(不用注明条件) .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com