
【题目】为测定碳酸钠纯度(只含有少量氯化钠),学生设计了如下两个实验方案。
[方案1]称取![]() 样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
样品,置于小烧杯中,加适量水完全溶解;向小烧杯中加入足量氢氧化钡溶液,过滤,洗涤、干燥沉淀,称量沉淀的质量为19.700克,计算。
(1)写出生成沉淀的反应方程式__________________。
(2)过滤操作需要的玻璃仪器__________________。
(3)计算碳酸钠的质量分数为______________(保留两位小数)。
[方案2]用下图装置,排液法测定![]() 的体积,并根据样品质量和
的体积,并根据样品质量和![]() 的体积计算
的体积计算
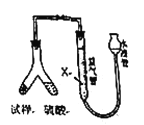
(4)为了减小测定![]() 的体积误差,量气管中加入的液体
的体积误差,量气管中加入的液体![]() 为______(填化学式)。
为______(填化学式)。
(5)通过实验,测得该试样中碳酸钠的质量分数偏高,产生这种现象的原因可能是______。
A.测定气体体积时未冷却至室温
B.气体进入量气管前未用浓硫酸干燥
C.![]() 型管中留有反应生成的气体
型管中留有反应生成的气体
D.反应结束后读数时水准管的水面高于量气管的水面
【答案】![]() 烧杯、玻璃棒、漏斗 0.88
烧杯、玻璃棒、漏斗 0.88 ![]() A
A
【解析】
(1)碳酸钠与氢氧化钡反应,生成碳酸钡和氢氧化钠,反应方程式为![]() ;
;
(2)过滤操作需要的玻璃仪器为烧杯、玻璃棒、漏斗。
(3)设样品中所含碳酸钠的质量为x
![]()
106g 197g
X 19.700g
由此求出x=10.600g
碳酸钠的质量分数为![]()
(4)为了减小测定![]() 的体积误差,即尽可能减少二氧化碳的溶解损失,量气管中加入的液体
的体积误差,即尽可能减少二氧化碳的溶解损失,量气管中加入的液体![]() 为饱和碳酸氢钠溶液。
为饱和碳酸氢钠溶液。
(5)A.测定气体体积时未冷却至室温,气体体积膨胀,排出的气体量多,量出的气体体积大,测得该试样中碳酸钠的质量分数偏高;
B.气体进入量气管前未用浓硫酸干燥,在排液时溶解在溶液中,不产生误差;
C.![]() 型管中留有反应生成的气体,气体替换了反应器内的空气,不产生误差;
型管中留有反应生成的气体,气体替换了反应器内的空气,不产生误差;
D.反应结束后读数时水准管的水面高于量气管的水面,读取的体积偏小,测得该试样中碳酸钠的质量分数偏低。
故选A。


科目:高中化学 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2 g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)________。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是 _______、_______、 _______。
(3)下列情况会使所配溶液浓度偏高的是(填序号)______。
a.没进行上述的操作步骤D
b.加蒸馏水时,不慎超过了刻度线
c.砝码上沾有杂质
d.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列与“物质的量”相关的计算。
(1)标准状况下,33.6LCO2的物质的量为___mol,质量为___g,所含O原子的数目是____个。
(2)同温同压下,同体积的氨(NH3)和硫化氢(H2S)气体的质量之比是____,同质量的氨和硫化氢气体所含氢原子个数之比是___。
(3)agCl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,50mL 0.10mol/L的醋酸中存在着如下平衡:CH3COOH ![]() CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
CH3COO―+H+。若分别作如下改变,对上述平衡有何影响
(1)加入少量冰醋酸,平衡将_______________________,溶液中c(H+)将________________;
(2)加入一定量蒸馏水,平衡将__________________,溶液中c(H+)将__________;
(3)加入少量0.10mol/L盐酸,平衡将________________,溶液中c(H+)将_________________;
(4)加入20 mL 0.10mol/L的NaOH溶液,平衡将__________________,溶液中c(H+)将__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400 ℃时,将一定量的SO2和 14 mol O2压入一个盛有催化剂的10 L密闭容器中进行反应:2SO2+O2 ![]() 2SO3
2SO3
已知 2 min后,容器中剩余 2 mol SO2和12 mol O2。试计算:
(1)生成SO3的物质的量。______
(2)SO2的起始物质的量浓度。______
(3)2 min 内SO2和SO3的反应速率。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气可以制备大量的化工原料。请回答下列问题:
(1)由天然气制备合成气(CO和H2),进而可合成H2C2O4。
①欲加快H2C2O4溶液使5mL0.01mol/L酸性KMnO4溶液褪色,可采取的措施有__________、_______________(写两点)。
②下列可以证明H2C2O4是弱酸的是___________。
A.H2C2O4可以分解为CO、CO2和H2O
B.常温下,0.1mol/LNaHC2O4溶液中c(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4溶液25mL可以消耗0.1mol/LNaOH溶液50mL
D.常温下,0.05mol/L的H2C2O4溶液pH≈4
(2)已知:①CO(g)+H2(g)![]() C(s)+H2O(g) △H1=-130kJ/mol
C(s)+H2O(g) △H1=-130kJ/mol
②CH4(g)![]() C(s)+2H2(g) △H2=+76kJ/mol
C(s)+2H2(g) △H2=+76kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H20(g) △H3=+41kJ/mol
CO(g)+H20(g) △H3=+41kJ/mol
则CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) △H=________。
2H2(g)+2CO(g) △H=________。
(3)向2L容器中通入3molCO2、3molCH4,在不同温度下,以镍合金为催化剂,发生反应:CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。

①高温下该反应能自发进行的原因是______________,930K时的平衡常数K=___________(保留两位小数)。
②请解释图中曲线随温度变化的原因______________。
③在700~1100K内,同温度下平衡转化率:CO2________CH4(填“大于”、“ 小于”或“等于”),结合(2)提供的反应分析,其原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向碳酸钠溶液中加入足量的盐酸:CO32-+2H+=CO2↑+H2O
B.氢氧化钡溶液中加入足量稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++H2O![]() Fe(OH)3↓+H+
Fe(OH)3↓+H+
D.澄清石灰水中加盐酸:Ca(OH)2 +2H+ = Ca2+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种已投入生产的大型蓄电系统。电解质通过泵不断地在储罐和电池间循环;电池中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;图中左边的电解质为Na2S2、Na2S4,右边电解质为NaBr3、NaBr。充、放电时发生的反应为:Na2S4+3NaBr![]() 2Na2S2+NaBr3,下列说法正确的是
2Na2S2+NaBr3,下列说法正确的是
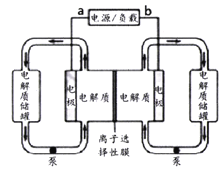
A. 充电时b端为电源负极
B. 在放电过程中钠离子通过离子选择膜的流向为从右到左
C. 电池充电时,阴极的电极反应为S42-+2e-=2S22-
D. 以此蓄电池为电源电解精炼铜,当有0.1 mol e-转移吋时,阳极有3.2g铜溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)基态磷原子的电子排布图为________________,与砷原子同周期且含有的未成对电子数相同的元素有________种。
(2)(SCN)2分子中各元素的电负性由大到小的顺序为______________(用元素符号表述),分子中σ键和п键个数比为____________,(SCN)2能与Cu2+形成配合物,理由是_______________________________。
(3)CO2是N2O的等电子体,N2O中中心原子的杂化轨道类型为_______________。
(4)砷的一种氧化物俗称“砒霜”,我国科研人员研究发现砒霜对白血病有明显的治疗作用,其结构如图1所示,“砒霜”的化学式为___________,“砒霜”在一定条件下能转化成Na3AsO4,Na3AsO4中阴离子的空间构型为____________________。
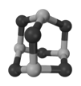
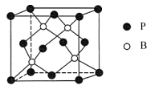
图1 图2
(5)磷化硼是一种耐磨材料,其晶胞结构如图2所示,晶体中一个B原子周围距离最近的P原子有____个;若B、P原子半径分别为r1pm和r2pm,阿伏加德罗常数值为NA,晶体密度为d g/cm3,则磷化硼晶胞中原子的体积占晶胞体积的百分率为________ ×100% (用含d、r1、r2 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com