
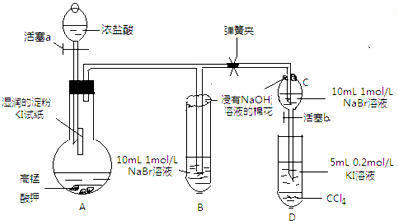
 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
分析 A装置:高锰酸钾具有强氧化性,与浓盐酸反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O生成氯气,氯气的氧化性强于碘,氯气与湿润的淀粉碘化钾反应:Cl2+2I-═I2+2Cl-,碘单质遇淀粉显示蓝色,B装置:氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-;浸有氢氧化钠的棉花吸收氯气、溴蒸气,C装置:验证溴的氧化性强于碘,C中生成的溴通入到盛有KI溶液的D中,发生氧化还原反应,静至后CCl4层溶液变为紫红色.
(1)氯气氧化性强于单质碘,碘遇淀粉变蓝色;
(2)如CCl4层溶液变为紫红色,则说明有碘生成,为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色;
(3)根据氧化剂的氧化性大于氧化产物的氧化性分析,氧化性Cl2>Br2>I2;
(4)当B中的溶液由黄色变为棕色时,关闭活塞a,保证C中还存有溴离子,避免氯气干扰溴与碘化钾的反应.
解答 解:(1)高锰酸钾具有强氧化性,与浓盐酸反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O生成氯气,氯气的氧化性强于碘,氯气与湿润的淀粉碘化钾反应:Cl2+2KI═I2+2KCl,碘单质遇淀粉显示蓝色,
故答案为:A中湿润的淀粉碘化钾试纸变蓝;Cl2+2KI═I2+2KCl;
(2)为验证溴的氧化性强于碘,应将C中生成的溴加入到盛有KI溶液的D中,如发生氧化还原反应,则静至后CCl4层溶液变为紫红色,操作为:打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘,反应为:2I-+Br 2=2Br-+I2,
故答案为:打开活塞b,将分液漏斗中的黄色溶液滴入D中,关闭活塞b,取下试管D振荡,静置,观察到D中CCl4层溶液变为紫红色,说明溴的氧化性强于碘;2I-+Br 2=2Br-+I2;
(3)氧化剂的氧化性大于氧化产物的氧化性,氯气与湿润的淀粉碘化钾反应:Cl2+2KI═I2+2KCl,碘单质遇淀粉显示蓝色,氯气的氧化性强于碘,B装置:将氯气通入NaBr溶液中会有单质溴生成,氯的氧化性强于溴,C中生成的溴加入到盛有KI溶液的D中,2KI+Br 2=2KBr+I2,溴的氧化性强于碘,所以氧化性Cl2>Br2>I2,
故答案为:Cl2>Br2>I2;
(4)B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,如有氯气,氯气会继续氧化溴离子,所以能保证氯气不干扰溴与碘化钾的反应,
故答案为:B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应.
点评 本题为探究题和实验设计题,用以比较卤素单质的氧化性强弱,注意本题中要排除干扰因素的存在,掌握氧化还原反应有关知识以及卤素的性质是解答的关键,综合考查了学生灵活运用知识的能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质的沸点:W>X | B. | Y的最高化合价为+7 | ||
| C. | 原子半径:r(W)<r(X)<r(Y)<r(Z) | D. | W、X、能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
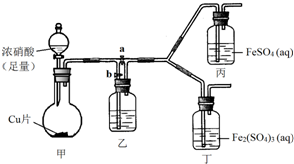 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO${\;}_{3}^{-}$+2H+=Fe3++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象 | 离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 高温或日常用的消毒剂可使禽流感病毒蛋白质变性 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
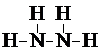 .
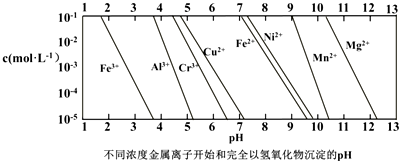
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com