解:(1)氨的催化氧化反应,氨气中-3价的氮被氧气氧化成显+2价的一氧化氮,化学反应方程式为:4NH
3+5O
2
4NO+6H
2O,
故答案为:4NH
3+5O
2
4NO+6H
2O;
(2)B装置是氨水滴入到氢氧化钠固体上,NaOH固体溶于水放出大量热,氨气在温度高的情况下溶解度小,在氨水中存在平衡:NH
3+H
2O?NH
3?H
2O?NH
4++OH
-,平衡向左移动;加入NaOH固体,氢氧化钠电离出氢氧根离子,OH
-浓度增加,平衡向左移动,
故答案为:在氨水中存在平衡:NH
3+H
2O?NH
3?H
2O?NH
4++OH
-,加入NaOH固体,OH
-浓度增加,平衡向左移动,NaOH固体溶于水放出大量热,均有利于NH
3逸出;
(3)①氨气发生了催化氧化的产物一氧化氮,一氧化氮极易和氧气化合为二氧化氮,即2NO+O
2=2NO
2;所以装置F中有红棕色气体产生,
故答案为:2NO+O
2═2NO
2;
②乙观察到装置F中只有白烟生成,白烟是由于氨气和硝酸反应NH
3+HNO
3=NH
4NO
3,生成了白色的NH
4NO
3固体,
故答案为:NH
4NO
3;
③在装置G中,生成的二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为:3NO
2+H
2O═2HNO
3+NO,获得硝酸,金属铜和硝酸反应,3Cu+8HNO
3(稀)=3Cu(NO
3)
2+2NO↑+4H
2O实质是:3Cu+8H
++2NO
3-=3Cu
2++2NO↑+4H
2O,
故答案为:3Cu+8H
++2NO
3-=3Cu
2++2NO↑+4H
2O;
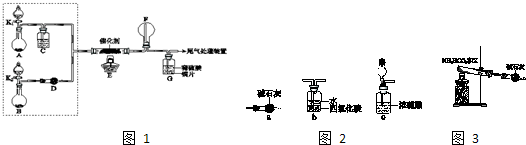
(4)①为了氧化氨气,氧气需过量,需增加氧气的量,减少氨气的量,A为制氧气的装置,增加A中氧气的量,装置A中的产气量,装置B中的产气量,
故答案为:增加; 减少;
②E装置是氨气的催化氧化装置,从装置中出来的气体中有氧气和氨气和一氧化氮和水蒸气,因4NO+2H
2O+3O
2=4HNO
3,NH
3+HNO
3=NH
4NO
3,所以避免F中生成硝酸铵,实现在F中看到红棕色的二氧化氮,需除去水或氨气,需在装置E、F间增加一个装置,该装置可以将氨气或水除去,a碱石灰吸收水蒸气,可以通过防倒吸的b装置吸收氨气,可以通过浓硫酸吸收氨气和水蒸气,实现在F中看到红棕色的二氧化氮,需选abc,
故答案为:abc;
(5)为实现2NO+O
2═2NO
2该反应,须生成氧气,碳酸氢铵受热分解生成氨气和水和二氧化碳,放出的CO
2和H
2O与Na
2O
2反应生成O
2,
故答案为:Na
2O
2;NH
4HCO
3分解放出NH
3;同时放出的CO
2和H
2O与Na
2O
2反应生成O
2;
分析:(1)氨的催化氧化产物是一氧化氮和水,据此来书写反应方程式;
(2)根据化学平衡移动的影响因素解答;
(3)①氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮;
②氨气和硝酸反应生成硝酸铵;
③二氧化氮和水反应获得硝酸,铜和硝酸反应生成硝酸铜、一氧化氮和水;
(4)①为了氧化氨气,氧气需过量,需增加氧气的量,减少氨气的量;
②在F中看到红棕色的二氧化氮,避免生成硝酸铵,需不买呢生成硝酸,需除去水或氨气,在装置E、F间增加一个装置,该装置可以是将氨气或水除去,剩下一氧化氮和未反应的氧气;
(5)根据反应须制取氧气,可根据可选的药品结合装置解答;
点评:本题主要考查了氨气的催化氧化,解答须掌握该反应的原理和相关物质的性质,题目难度中等.

 4NO+6H2O,
4NO+6H2O, 4NO+6H2O;
4NO+6H2O;

 名校课堂系列答案
名校课堂系列答案