
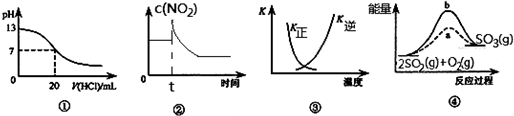
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 | |
| C. | 图③中曲线表示反应N2 (g)+3 H2(g)═2NH3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| D. | 图④中a、b曲线分别表示反应2SO2(g)+O2(g)═2SO3(g)△H<0使用(a)和未使用(b)催化剂时,应过程中的能量变化 |
分析 A.0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液时,消耗10mL盐酸;
B.平衡时浓度应该大于原来的浓度;
C.升高温度平衡逆移,正反应的平衡常数减小;
D.该反应为放热反应,反应物的总能量大于生成物的总能量.
解答 解:A.0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液时,消耗10mL盐酸,即所加盐酸的体积为10mL时,酸碱恰好反应溶液pH=7,题中图象不符合,故A错误;
B.充有NO2的恒温密闭容器在t时刻增大压强时,容器的体积减小,则NO2的浓度突然增大,平衡向生成N2O4的方向移动,NO2的浓度逐渐减小,但是平衡时浓度应该大于原来的浓度,故B错误;
C.该反应正方向为放热反应,升高温度平衡逆移,正反应的平衡常数减小、逆反应平衡常数增大,题中图象符合实际,故C正确;
D.该反应为放热反应,反应物的总能量大于生成物的总能量,即图象中SO2(g)与O2(g)的位置高于SO3(g)的位置,题中图象不符合,故D错误.
故选C.
点评 本题考查图象的有关知识,题目涉及中和滴定、化学平衡移动、化学平衡常数、化学反应中的能量变化图等,题目难度中等,侧重于考查学生的读图能力和分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{77}^{192}$Ir核外含有115个电子 | B. | Ir为非金属元素 | ||
| C. | ${\;}_{77}^{192}$Ir的中子数是115 | D. | ${\;}_{77}^{192}$Ir的质量数是77 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
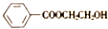 )和N(
)和N( )
)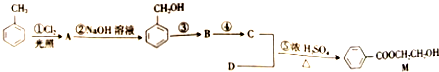
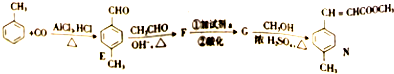
 )是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构).
)是E经多步反应的产物,与R共有相同官能团且官能团都直接连在六元环上,则满足上述条件R的共同异构体还有18种(不考虑立体异构). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| B. | P、S、Cl最高正价依次降低 | |
| C. | HCl、HBr、HI的稳定性依次增强 | |
| D. | 钠、镁、铝的金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和水 | B. | CO2和NaOH溶液 | C. | NO和水 | D. | Cl2和NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 溶液中各离子浓度由大到小的顺序为:c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | |
| C. | 2 c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| D. | 配制0.1mol•L-1的Na2S溶液时需加少量的KOH抑制S2-的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数:X>Y>Z | B. | 粒子半径:r(W3+)>r(Y2-)>r(Z+) | ||
| C. | MY2与Z2Y的化合物类型相同 | D. | 单质沸点:M>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
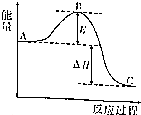 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.请回答下列问题.
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com