
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示.下列说法中正确的是( ) 
A.燃料电池工作时,正极反应:O2+2H2O+4e﹣═4OH﹣
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,随着反应的进行浓度减小
D.a、b两极均是石墨时,在相同条件下b极产生的气体与电池中消耗的H2体积相等
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去).

注:C中为氧化铜粉末,试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为:________________________________;
(2)乙同学认为还可能产生氢气的理由是:____________________________________;
(3)丙同学在安装好装置后,必不可少的一步操作是:__________________________;
(4)A中试剂是______,D中试剂是______;
(5)E装置的作用是_________________________;
(6)可以证明气体X中含有氢气的实验现象是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某HNO3和Fe(NO3)3的混合溶液中逐渐加入铁粉,产生无色气体,该气体遇空气变红棕色,溶液中Fe2+浓度和加入Fe粉的物质的量之间的关系如下图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )
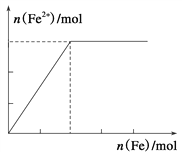
A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.乙酸的结构简式:C2H4O2
B.F﹣的结构示意图: ![]()
C.中子数为20 的氯原子:2017Cl
D.NH3 的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.氯化铝溶液中加入过量的氨水:Al3++4 NH3H2O=AlO2﹣+4 NH4+
B.稀硝酸中加入过量铁粉:Fe+4H++NO3﹣=Fe3++NO↑+2H2O
C.二氧化锰与浓盐酸混合加热:MnO2+4H++2Cl﹣ ![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.石灰水中加入过量小苏打溶液:HCO3﹣+Ca2++OH﹣=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A、B、C、D是中学化学常见的混合物分离或提纯的基本装置。
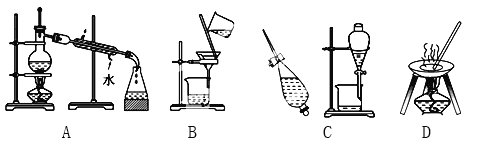
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪一种装置,将A、B、C、D填入适当的空格中。
(1)从碘水中提取碘_____________________________;
(2)实验室制取蒸馏水_____________________________;
(3)去粗盐中的泥沙_____________________________;
(4)与海水晒盐原理相符的是___________________________。
Ⅱ.现有下列八种物质:①HCl气体②Cu ③CO ④CO2 ⑤金刚石 ⑥KMnO4固体 ⑦Ba(OH)2溶液 ⑧熔融KAl(SO4)2
(1)属于单质的是_________;属于酸性氧化物的是_________;所给状态能导电的电解质是_________;(填所给物质的序号)
(2)写出Ba(OH)2在水中的电离方程式:____________________________________________;
(3)用双线桥表示该反应中电子转移的方向和数目_______
2KMnO4+16HCl=5Cl2↑+2MnCl2+2KCl+8H2O
若有0.8mol还原剂被氧化,则转移电子的物质的量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列两个反应:
①Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
②Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
说法正确的是
A.浓硫酸均为氧化剂B.Cu和Na2SO3均为还原剂
C.只有①为氧化还原反应D.只有②为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1molL﹣1 NaOH溶液450mL和0.5molL﹣1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是①(填序号),配制上述溶液还需用到的玻璃仪器是②(填仪器名称).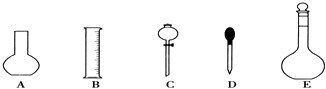
(2)根据计算用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1molL﹣1(填“大于”、“等于”或“小于”).
(3)由计算知,所需质量分数为98%、密度为1.84gcm﹣3的浓硫酸的体积为mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是将浓硫酸沿烧杯壁缓缓倒入水中,并用玻璃棒不断搅拌.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com