
���� ��1����֪��N2��g��+O2��g��?2NO��g����H=+180.50kJ•mol-1��
2CO��g��+O2��g��?CO2��g����H=-566.00kJ•mol-1��
���ݸ�˹���ɣ���-�ٵõ���2NO��g��+2CO��g��$\frac{\underline{\;����\;}}{\;}$2CO2��g��+N2��g���ݴ˼��㣻
��2������ʼʱ��NOΪ4mol��ƽ��ʱNOΪ0.2mol�����ݷ���ʽ���ƽ��ʱCO��CO2��N2��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻����Qc��k����Դ�С������
�ڴ���������ϴ�Ӧ���ʿ죬�ﵽƽ������ʱ��̣�
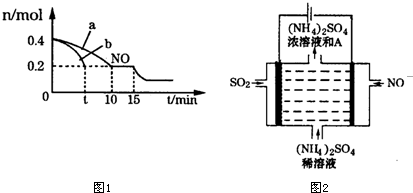
����ͼ���֪��NO��Ũ�ȼ�С��ƽ�����������ƶ���
��3��̼������Һ��SO2��Ӧ�������������ƺͶ�����̼��
��4�����װ�D�ɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42-�����ⷽ��ʽΪ5SO2+2NO+8H2O$\frac{\underline{\;���\;}}{\;}$��NH4��2SO4+4H2SO4�����ݵ�ⷽ��ʽ��ϵ��ԭ��������
��� �⣺��1����֪��N2��g��+O2��g��?2NO��g����H=+180.50kJ•mol-1��
2CO��g��+O2��g��?CO2��g����H=-566.00kJ•mol-1��
���ݸ�˹���ɣ���-�ٵõ���2NO��g��+2CO��g��$\frac{\underline{\;����\;}}{\;}$2CO2��g��+N2��g����H=-746.50 kJ•mol-1��
�ʴ�Ϊ��2NO��g��+2CO��g��$\frac{\underline{\;����\;}}{\;}$2CO2��g��+N2��g����H=-746.50 kJ•mol-1��
��2������ʼʱ��NOΪ0.4mol��ƽ��ʱNOΪ0.2mol��
2NO��g��+2CO��g��$\frac{\underline{\;����\;}}{\;}$2CO2��g��+N2
��ʼ���ʵ�����0.4mol 0.4mol 0 0
ת������������0.2mol 0.2mol 0.2mol 0.1mol
ƽ�����ʵ�����0.2mol 0.2mol 0.2mol 0.1mol
��ƽ��ʱ��Ũ�ȣ�c��NO��=0.1mol/L��c��CO��=0.1mol/L��c��CO2��=0.1mol/L��c��N2��=0.05mol/L��
k=$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$=$\frac{0��{1}^{2}��0.05}{0��{1}^{2}��0��{1}^{2}}$=5��mol/L��-1��
ƽ��ʱ�������¶Ȳ��䣬���������г���CO��N2��0.8mol����c��CO��=0.5mol/L��c��N2��=0.45mol/L��
Qc=$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$=$\frac{0��{1}^{2}��0.45}{0��{1}^{2}��0��{5}^{2}}$=1.8��k����ƽ�⽫�����ƶ���
�ʴ�Ϊ��5��mol/L��-1�����ң�
�ڴ���������ϴ�Ӧ���ʿ죬�ﵽƽ������ʱ��̣���ͼ��֪��b���ߴ����������·�Ӧ���ʿ죬����b�Ĵ����ı������
�ʴ�Ϊ��b��
����ͼ���֪��NO��Ũ�ȼ�С��ƽ�����������ƶ������Ըı������Ϊ����CO�����ʵ���Ũ�Ȼ�����ѹǿ��
�ʴ�Ϊ������CO�����ʵ���Ũ�Ȼ�����ѹǿ��
��3��̼������Һ��SO2��Ӧ�������������ƺͶ�����̼���䷴Ӧ�����ӷ���ʽΪ��H2O+2SO2+CO32-�T2HSO3-+CO2����
�ʴ�Ϊ��H2O+2SO2+CO32-�T2HSO3-+CO2����
��4�����װ�D�ɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42-�����ⷽ��ʽΪ5SO2+2NO+8H2O$\frac{\underline{\;���\;}}{\;}$��NH4��2SO4+4H2SO4��
���ɵ�ⷽ��ʽ��֪������AΪ���ᣬ��Ļ�ѧʽH2SO4�� ���ʱ�������϶�������ʧ����������������ӣ��������ĵ缫��Ӧʽ��SO2+2H2O-2 e-�TSO42-+4H+��
�ʴ�Ϊ��H2SO4��SO2+2H2O-2 e-�TSO42-+4H+��
�ڵ��ʱNO��SO2�ֱ�ת��ΪNH4+��SO42-�����ԭ���غ��֪��ⷽ��ʽΪ��5SO2+2NO+8H2O$\frac{\underline{\;���\;}}{\;}$��NH4��2SO4+4H2SO4��
�ʴ�Ϊ��5SO2+2NO+8H2O$\frac{\underline{\;���\;}}{\;}$��NH4��2SO4+4H2SO4��
���� ���⿼���Ϊ�ۺϣ��漰��˹���ɵ�Ӧ�á���ѧƽ���ƶ���ƽ�ⳣ���ļ��㡢���ԭ����Ӧ�ã���Ŀ�Ѷ��еȣ������ڿ���ѧ���Ի���֪ʶ���ۺ�Ӧ�������ͼ���������ע���������ʽ�ڻ�ѧƽ������е�Ӧ�ã�


 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H��0����S��0 | B�� | ��H��0����S��0 | C�� | ��H��0����S��0 | D�� | ��H��0����S��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �ζ� ���� | ������Һ�������mL�� | 0.100 0mol•L-1NaOH�������mL�� | ||
| �ζ�ǰ�̶� | �ζ���̶� | ��Һ�����mL�� | ||
| ��һ�� | 20.00 | 0.00 | 26.11 | 26.11 |
| �ڶ��� | 20.00 | 1.56 | 30.30 | 28.74 |
| ������ | 20.00 | 0.22 | 26.31 | 26.09 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
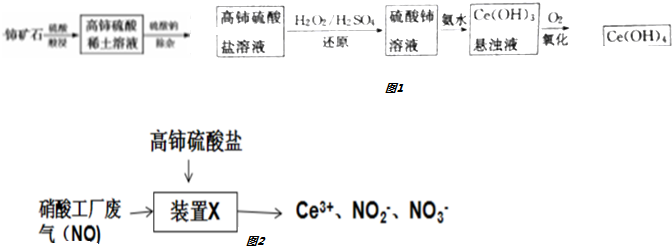
 2SO2��g��+O2��g��?2SO3��g����H=a kJ•mol-1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99kJ����ش�
2SO2��g��+O2��g��?2SO3��g����H=a kJ•mol-1����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g����ȫת��Ϊ1mol SO3��g������99kJ����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�3.2 g O3����������Ϊ1.2 NA | |
| B�� | ��״���£�2.24 L CCl4�к��е�C-Cl������ĿΪ0.4 NA | |
| C�� | ��״���£�11.2 L NO��11.2 L O2�������ԭ����Ϊ2 NA | |
| D�� | ��0.1 mol�Ȼ�������1 Lˮ�У�������Һ����0.1 NA Fe3+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com