
| A. | 在多电子的原子里,能量高的电子通常在离核远的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
分析 A、原子核外区域能量不同,离核越近能量越低,离核越远能量越高;
B.根据电子首先进入能量最低、离核最近的轨道判断;
C.微粒可能为不同的分子,也可能为阳离子与阴离子;
D.根据通常认为最外层有8个电子(最外层是第一电子层时有2个电子)的结构是一种稳定结构.
解答 解:A、原子核外区域能量不同,离核越近能量越低,离核越远能量越高,所以在多电子的原子里,能量高的电子通常在离核远的区域内活动,故A正确;
B.核外电子总是先排在能量低的,但排满了M层的p轨道后就排N层的s轨道,后再排M层的d轨道,不是排满了M层后才排N层,故B错误;
C.微粒可能为不同的分子,也可能为阳离子与阴离子,如钠离子与Ne原子,二者性质不同,故C错误;
D.通常认为最外层有8个电子(最外层是第一电子层时有2个电子)的结构是一种稳定结构,故D错误;
故选:A.
点评 本题考查核外电子排布规律以及元素化学性质和原子构成的关系,要知道电子首先进入能量最低、离核最近的轨道,难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题

| A. | 将各1mol的两种物质分别与氢氧化钠溶液充分反应,消耗等量氢氧化钠 | |
| B. | 将各1mol的两种物质分别与溴水充分反应,消耗等量溴分子 | |
| C. | 将各1mol的两种物质分别与氢气充分反应,消耗等量氢气 | |
| D. | 两种有机物中的所有原子均不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3经催化氧化生成NO | B. | NO与O2反应生成NO2 | ||
| C. | N2与H2在一定条件下反应生成NH3 | D. | 由NH3制碳酸氢铵和硫酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
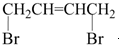 可经三步反应制取
可经三步反应制取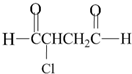 ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A. | 水解反应、加成反应、氧化反应 | B. | 加成反应、水解反应、氧化反应 | ||
| C. | 水解反应、氧化反应、加成反应 | D. | 加成反应、氧化反应、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存硫酸亚铁溶液时,向其中加入铁钉和少量硫酸 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 少量液溴可用水封存,防止溴挥发 | |
| D. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
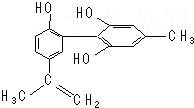 我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有原子有可能共平面 | |
| D. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 | 8960mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com