
【题目】室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是
选项 | 加入的物质 | 结论 |
A | 50mL 1mol·L﹣1H2SO4 | 反应结束后,c(Na+)=c(SO42﹣) |
B | 0.05mol CaO | 溶液中 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH﹣)不变 |
D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
【答案】B
【解析】
A.n(H2SO4)=1mol/L×0.05L=0.05mol=n(Na2CO3),所以二者恰好完全反应生成Na2SO4,Na2SO4是强电解质,完全电离,则溶液中存在c(Na+)=2c(SO42-),故A错误;B.加入0.05molCaO,发生的一系列反应为CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,且氢氧化钙和碳酸钠前后完全反应,导致溶液中c(OH-)增大、c(CO32-)减小,则溶液中![]() 增大,故B正确;C.加入水后,溶液中c(Na2CO3)减小,pH减小,则溶液中c(H+)减小,水电离出的c(H+)=c(OH-),所以该溶液中水电离出的c(H+)c(OH-)减小,故C错误; D.Na2CO3水解导致溶液呈碱性,NaHSO4和Na2CO3反应方程式为:2NaHSO4+Na2CO3=Na2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成Na2SO4、H2O、CO2,溶液中的溶质是Na2SO4,溶液呈中性,溶液的pH减小,加入的硫酸氢钠中含有钠离子,所以c(Na+)增大,故D错误;故选B。
增大,故B正确;C.加入水后,溶液中c(Na2CO3)减小,pH减小,则溶液中c(H+)减小,水电离出的c(H+)=c(OH-),所以该溶液中水电离出的c(H+)c(OH-)减小,故C错误; D.Na2CO3水解导致溶液呈碱性,NaHSO4和Na2CO3反应方程式为:2NaHSO4+Na2CO3=Na2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成Na2SO4、H2O、CO2,溶液中的溶质是Na2SO4,溶液呈中性,溶液的pH减小,加入的硫酸氢钠中含有钠离子,所以c(Na+)增大,故D错误;故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铝土矿是冶炼金属铝的重要原料,其中主要成分为 Al2O3、Fe2O3 等。工业上可 NaOH 溶解 Al2O3 使 其与杂质分离:Al2O3+2NaOH═2NaAlO2+H2O
(1)找出上述反应中化合价为负值的元素,写出其原子的电子式_____。
(2)同温同压下,上述元素形成的气体密度最大的物质的分子式为_____。
(3)上述反应中两种金属元素对应单质的活泼性强弱关系为:____,从原子结构的角度分 析其原因:_________。
(4)若根据化学性质进行物质分类,则 Al2O3 属于______氧化物,据此推测下列反应方程式正确的是______。
A.Al2O3+3H2O═2Al(OH)3
B.2Al(OH)3+3H2SO4═Al2(SO4)3+3H2O
C.Al(OH)3+NaOH═NaA1O2+2H2O
D NaAlO2+4HCl═AlCl3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项是关于玻璃棒在若干实验中的用途及操作,其中不正确的是( )
A.溶解物质时搅拌
B.蘸取少量溶液做焰色试验
C.过滤时向漏斗中转移液体
D.配制一定物质的量浓度的溶液时引流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、磷及其化合物是非常重要的物质。
(1)Cu+的电子排布式____;
(2)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-。[Cu(CN)4]2-的配体为____,[Cu(CN)4]2-中C的杂化方式为____,则1个[Cu(CN)4]2-中含有的σ键的数目为____个;
(3)锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,不溶于水,可通过Na3PO4、CuSO4和NH3·H2O反应制取。制取Cu4O(PO4)2的化学方程式为____;
(4)PCl5中P-Cl键长有198pm和206pm两种。PCl5是非极性分子,可作为导电熔体,其原理为PCl5电离为一个阴离子和一个阳离子,其中阴离子为正八面体,阳离子为正四面体,写出一种阳离子的等电子体的化学式____,PCl5的立体构型为____;
(5)金属铜属于面心立方晶体,铜的密度为ag·cm3,NA表示阿伏伽德罗常数,则铜的配位数____,铜的金属半径为___pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌-空气电池(原理如图)适宜用作城市电动车的动力电源,放电时Zn转化为ZnO。则该电池放电时下列说法正确的是()

A.将电能转化为化学能
B.氧气在石墨电极上发生氧化反应
C.电子由Zn电极经导线流向石墨电极
D.该电池放电时OH-向石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2![]() Hg+SO2 还原出的汞呈气态,冷凝得液态汞。其流程如下图:
Hg+SO2 还原出的汞呈气态,冷凝得液态汞。其流程如下图:
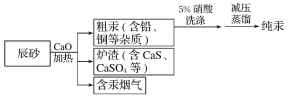
下列说法中,不正确的是
A. HgS+O2![]() Hg+SO2 属于置换反应
Hg+SO2 属于置换反应
B. 含汞烟气必须处理达标后才能排放
C. 流程中加入氧化钙的目的是减少SO2的排放
D. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL浓度均为0.10 mol/L的CH3COOH 溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
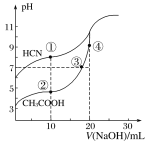
A. 室温下,电离平衡常数:K(HCN)>K(CH3COOH)
B. 点①和点②所示溶液中:c(CH3COO-)>c(CN-)
C. 点③所示的溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
D. 点④所示的溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列物质间的反应,能够说明“反应条件(如温度、浓度、用量等)不同得到产物不同”的观点的是( )
A.金属钠与水B.铁粉与盐酸
C.氢气与氯气D.二氧化碳和澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关油脂的叙述不正确的是( )
A.天然油脂是混合物,没有固定的熔点和沸点
B.油脂是酯的一种
C.油脂是由高级脂肪酸和甘油所生成的酯
D.油脂都不能使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com