

分析 (1)A是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,B、C有外接电源,属于电解池;A原电池中,锌作负极,负极上锌失电子发生氧化反应,B是电解池,③作阳极,阳极上氯离子放电,⑤为阳极,发生氧化反应;
(2)⑥中铜电极上银离子得电子析出,根据锌、银和电子之间的关系式解答;
(3)电镀池的电解质溶液浓度不变.
解答 解:(1)A是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,B有外接电源,属于电解池,C为电解池或电镀池,
故答案为:原电池;电解池;电镀池(电解池),
A原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,
B是电解池,③作阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,
C是电镀池,⑤为阳极,发生氧化反应,电极方程式为2Ag-2e-═2Ag+,
故答案为:Zn-2e-═Zn2+;2Cl--2e-═Cl2↑;2Ag-2e-═2Ag+;
(2)当电路上有2mol电子流过时,
⑥中铜电极上银离子得电子析出,电极反应式为:Ag++e-=Ag,当电路上有2mol电子流过时析出银的质量=2mol×108g/mol=216g,
故答案为:216;
(3)C为电镀池,阳极银失电子发生氧化反应,阴极上是溶液中银离子得到电子发生还原反应,电解质溶液浓度保持不变,故答案为:C池.
点评 本题考查了原电池和电解池原理,题目难度不大,正确判断原电池和电解池是解本题关键,电极反应式的书写是学习难点.


科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 将Na2CO3和NaHCO3的固体混合物加热灼烧 | 除去NaHCO3中的Na2CO3 |
| B | 常温时将CO通过装有SiO2的硬质玻璃管 | 制取粗硅 |
| C | 向新制得的K2S溶液中滴加新制的氯水 | 比较氯与硫的得电子能力 |
| D | 分别向2支盛有冷水的试管中加入相同大小的镁条和铝条 | 比较镁铝的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体平均相对分子质量保持一定 | |
| B. | 单位时间内每生成3mol C的同时,生成1 mol B | |
| C. | 容器内气体密度恒定不变 | |
| D. | 反应前后容器内总压强恒定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “春蚕到死丝方尽,蜡炬成灰泪始干”中“丝”和“泪”分别是蛋白质和高级烃 | |
| B. | 可用 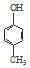 和HCHO为原料合成 和HCHO为原料合成 | |
| C. | 漂白粉因主要成分是CaCl2故暴露在空气中不易变质 | |
| D. | 按照分散质和分散剂所处状态的不同可以把分散系分为9种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中C、H、O个数比为1:2:3 | |
| B. | 分子中碳氢原子个数比为2:1 | |
| C. | 有机物中必定含氧元素 | |
| D. | 无法判断有机物中是否含有氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.6% | B. | 15.7% | C. | 28% | D. | 32.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图a所示装置干燥SO2气体 | |
| B. | 用图b所示装置蒸发KNO3溶液得硝酸钠晶体 | |
| C. | 用图c所示装置分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 用图d所示装置测量氨气的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com