
| A | B | C | D |
| 汽油 | 氧化钠 | 浓硫酸 | 天然气 |
 易燃气体 |  氧化剂 |  腐蚀品 |  易燃气体 |
| A. | A | B. | B | C. | C | D. | D |
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨时使用催化剂 | |
| B. | 配制SnCl2溶液时加入一定量的盐酸 | |
| C. | 25℃时,在稀硫酸溶液中由水电离出的c(H+)<1×10-7mol/L | |
| D. | AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
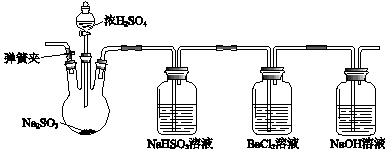
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.1mol | ||
| C. | 小于0.1mol | D. | 大于0.1mol,小于0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每当固体质量减轻5.6g时,生成2.8g Si | |
| B. | 氧化剂和还原剂的物质的量之比为1:2 | |
| C. | 硅单质在常温下不与任何酸、碱反应 | |
| D. | 单质硅与单质碳均具有一定的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、NaOH
、NaOH .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/pm | 160 | 143 | 102 | 56 | 117 |
| 主要化合价 | +2 | +3 | +6,+4,-2 | -1 | +6,+4,-2 |
| A. | 元素A和B的最高价氧化物均可用作耐火材料 | |
| B. | 由元素B,C组成的化合物可以通过单质与单质化合制得,也可以在溶液中通过复分解反应制得 | |
| C. | 气态氢化物的还原性:C>E | |
| D. | D元素的非金属性最强,其最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com