
| A. | 丙烷分子的球棍模型是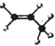 | B. | 2-氯甲苯的结构简式: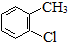 | ||
| C. | 乙醛分子的结构简式是CH3COH | D. | 葡萄糖、淀粉的最简式都是CH2O |
分析 A.丙烷中存在单键,C原子满足4对共价键,H原子形成1对共价键,据此判断;
B.官能团氯原子位于甲基的邻位,甲基处于苯环的1号C,则氯原子位于2号C;
C.乙醛的结构简式含有官能团醛基:-CHO,醛基的书写不规范;
D.最简式是用元素符号表示化合物分子中各元素的原子个数比的最简关系式;
解答 解:A.丙烷中含有3个碳原子和8个H原子,此球棍模型中少2个H,应为丙烯,故A错误;
B.2-氯甲苯中,氯原子处于甲基的邻位,其结构简式为: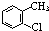 ,故B正确;
,故B正确;
C.乙醛中含有官能团醛基:-CHO,乙醛正确的结构简式为CH3CHO,故C错误;
D.葡萄糖的化学式为C6H12O6,故葡萄糖的最简式(实验式):CH2O,淀粉的化学式为(C6H10O5)n,故淀粉的最简式(实验式):C6H10O5,故D错误;
故选B.
点评 本题主要考查了有机物球棍模型、结构简式、最简式等知识,题目难度不大,注意掌握常见化学用语的表示方法.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题

| A. | 夏季气温高,PAN含量高 | |
| B. | 气压低,化学平衡常数增大,PAN含量高 | |
| C. | 减少氮氧化物的排放可以减少PAN的含量 | |
| D. | 大气中灰尘可起催化作用,能提高过氧乙酰基的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) | |
| D. | 将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: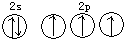 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气在生产、生活中具有广泛的应用.
天然气在生产、生活中具有广泛的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com