
| A. | Cs显+3价 | |
| B. | CsICl2溶于水,电离生成:Cs+、I-、Cl- | |
| C. | 酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
分析 CsICl2是一种碱金属的多卤化物,Cs为+1价,I为+1价,Cl为-1价,结合在化学反应中既可表现氧化性又可表现还原性来解答.
解答 解:A.Cs为+1价,I为+1价,Cl为-1价,故A错误;
B.Cs为+1价,I为+1价,Cl为-1价,所以CsICl2溶于水不能电离生成I-,故B错误;
C.-1价的Cl能被高锰酸钾溶液氧化,所以酸性高锰酸钾溶液中滴加CsICl2溶液,溶液褪色,故C正确;
D.CsICl2中I为+1价,在CsICl2溶液中通入C12,不能生成碘单质,故D错误;
故选C.
点评 本题考查氧化还原反应,明确物质中各元素的化合价是解答本题的关键,注意化合价降低表现氧化性,化合价升高表现还原性,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 将SO2通入含HClO的溶液中,生成H2SO4 | HClO酸性比H2SO4强 |
| D | 向FeCl2溶液中滴入KSCN溶液,在液面出现血红色 | Fe2+在空气中被氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
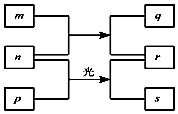 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | |
| B. | 元素的非金属性Z>X>Y | |
| C. | Y的氢化物常温常压下为气态 | |
| D. | X的最高价氧化物对应的水化物为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 向恒容密闭容器中充入2.0mol A和3.0mol B,发生反应xA(g)+2B(g)?yC(g).恒温下反应10min后突然改变某一条件,12min时达到化学平衡状态I;18min时升高温度,22min时达到化学平衡状态II.容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
向恒容密闭容器中充入2.0mol A和3.0mol B,发生反应xA(g)+2B(g)?yC(g).恒温下反应10min后突然改变某一条件,12min时达到化学平衡状态I;18min时升高温度,22min时达到化学平衡状态II.容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com