
| A. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=+725.8kJ/mol | |
| B. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=-1451.6kJ/mol | |
| C. | CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=-725.8kJ/mol | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g);△H=+1451.6kJ/mol |
分析 A、根据反应吸时焓变值为正值,放热时焓变值为负值来分析;
B、根据热化学方程式的书写原则以及方程式系数的含义来分析;
C、根据甲醇燃烧时的用量和放出的热量之间的关系进行回答;
D、水的状态错误.
解答 解:A、反应吸热时焓变值为正值,放热时焓变值为负值,甲醇燃烧是放热反应,故△H<0,故A错误;
B、0.1mol甲醇燃烧生成CO2和液态水时放热72.58kJ,则2mol甲醇即2mol甲醇燃烧放的热量为1451.6kJ,根据热化学方程式的书写方法写出为:2CH3OH(l)+3O2(g)2CO2(g)+4H2O(l)△H=-1451.6kJ/mol,水的状态错误,故B错误;
C、1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1,故C正确;
D、2CH3OH(l)+3O2(g)=2 CO2(g)+4H2O(l)△H=-1451.6 kJ•mol-1,水的状态错误,故D错误;
故选C.
点评 本题主要考查学生热化学方程式的书写方法及系数的含义,注意焓变的正负和单位问题,该题型是考试的热点.


科目:高中化学 来源: 题型:解答题
 1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应:
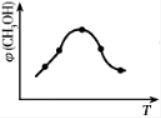
1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用反应: 模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.

 的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).
的△H=2△H1+△H2,(用含△H1、△H2的代数式表示).| 容器编号 | 实验条件 | 平衡时反应中的能量变化 |
| Ⅰ | 恒温恒容 | 放热Q1kJ |
| Ⅱ | 恒温恒压 | 放热Q2kJ |
| Ⅲ | 恒容绝热 | 放热Q3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步.火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备.
(1)“天宫一号”于2011年9月在酒泉卫星发射中心发射,标志着我国的航空航天技术迈进了一大步.火箭的第一、二级发动机中,所用的燃料为偏二甲胼和四氧化二氮,偏二甲肼可用胼来制备.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
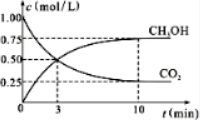
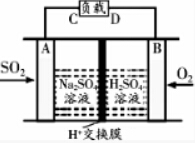
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,10mL0.02 mol•L-1 HCl溶液与10mL0.02 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=11 | |
| B. | 在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 中和物质的量浓度与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 配制三氯化铁溶液时应将三氯化铁溶于浓盐酸,再加水稀释至所需浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com