
| A. | Ag(NH3)2+ | B. | NH4+ | C. | OH- | D. | O22- |
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
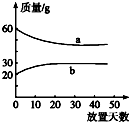 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )| A. | a升华、b冷凝 | B. | a冷凝、b吸水 | C. | a挥发、b潮解 | D. | a挥发、b吸水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基-3,3-二乙基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,2-二甲基-2-丁醇 | D. | 2,3-二甲基-1-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
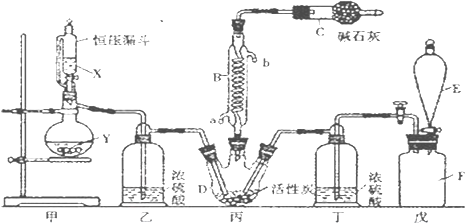
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
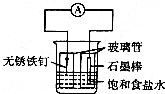 如图为铁的吸氧腐蚀实验装置,下列说法中错误的是( )
如图为铁的吸氧腐蚀实验装置,下列说法中错误的是( )| A. | 右玻璃管内液面高于左玻璃管内液面 | |
| B. | 溶液中的Cl-向铁钉方向移动 | |
| C. | 石墨棒做正极,电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 向插人铁钉的玻璃管内滴人Na0H溶液,可观察到铁钉附近的溶液中有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、NH3、SO3 | B. | CO2、CH4、C2H5OH | C. | NO、CaO、Ne | D. | P4、CS2、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:2 | C. | 2:3 | D. | 1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com