
| A、医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关 |
| B、蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| C、通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D、乙醇、乙酸均能与Na反应放出H2,二者分子中官能团种类相同 |


科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol/L) |
NaOH物质的量浓度 (mol/L) |
混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2=HCO3- |
| B、亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+OH-=SO32-+H2O |
| C、氯气通入冷水中 Cl2+H2O=Cl-+ClO-+2H+ |
| D、碳酸钙固体加醋酸 CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(NO3)2溶液中通入过量的SO2:3SO2+3Ba2++2NO3-+2H2O=3BaSO4+4H++2NO↑ |
| B、酸性高锰酸钾溶液中滴加H2O2溶液:4MnO4-+4H2O2+12H+=4Mn2++7O2+10H2O |
| C、溴化亚铁溶液中通入少量的氯气::2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl- |
| D、Fe2(SO4)3溶液中加入足量的Na2S溶液:2Fe3++3S2-=2FeS↓+S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中H2O是反应物之一 |
| B、氧化剂与还原剂的物质的量之比为1:5 |
| C、氧化产物为HIO3 |
| D、若有1mol I2参加氧化反应,转移10mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| B、若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9mol/L |
| C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D、NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 64 | 66 | 70 | 154 |
| 主要化合价 | +1 | -1 | -2 | +5、-3 | +1 |
| A、由Q与Y形成的化合物中只存在离子键 |
| B、Z与X之间形成的化合物具有还原性 |
| C、由X、Y、Z三种元素形成的化合物,其晶体一定是分子晶体 |
| D、Y与W形成的化合物中,Y显负价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L HF中含有的氟原子数目为NA(NA表示阿伏加德罗常数) |
| B、0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+) |
C、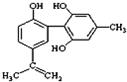 1mol如图所示物质与浓溴水反应时通常最多消耗Br2为4mol |
| D、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0,一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
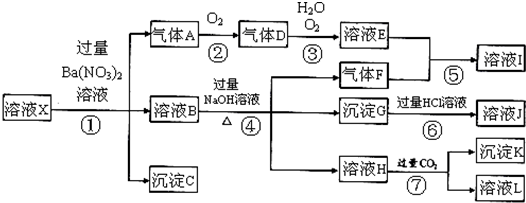
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com