
【题目】锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下:

请回答:
(1)分析步骤 II 中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是______________________, 其中, 可以采用加入_________________________来调节 pH ;
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
pH | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
1 | 114.32 | 0.750 | 0.059 |
2 | 114.4 | 0.086 | 0.056 |
3 | 113.68 | 0.034 | 0.054 |
4 | 113.60 | 0.010 | 0.050 |
5 | 112.43 | 0.010 | 0.050 |
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
温度 (℃) | ZnSO4.7H2O 回收量(g) | 产品中F的含量% | 产品中其他重金属含量% |
20 | 111.45 | 0.011 | 0.052 |
40 | 112.89 | 0.010 | 0.051 |
60 | 113.30 | 0.010 | 0.050 |
80 | 113.80 | 0.010 | 0.050 |
90 | 114.40 | 0.091 | 0.048 |
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式_________________________________________。 若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:_________________________;
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为___________________________;
②如何检验滤液B中是否含有铁元素_____________________________________;
③写出生成滤渣C的离子方程式__________________________________________;
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6 标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6 溶液进行滴定,所得数据如下表:
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 19.92 |
2 | 1.34 | 21.12 |
3 | 0.00 | 20.10 |
则 ZnSO4·7H2O 晶体的纯度是_______________(以质量分数表示,保留到小数点后两位)。
【答案】4,60oC ZnO MnO4- + 3Fe2+ + 7H2O = MnO2↓+ 3Fe(OH)3↓+ 5H+ 产生氮氧化合物污染环境 氢氧化铁、二氧化锰 在试管中取少量滤液B,滴加2滴KSCN溶液,若溶液变红则有铁元素,不变红则无铁元素 Zn + Cu2+ == Zn2+ + Cu 85.24%
【解析】
(1)①从表1可以看出,pH=4时,杂质含量最少,且ZnSO4.7H2O 回收量相对较多;温度60℃时,总体看,杂质含量最少,且ZnSO4.7H2O 回收量相对较多;从不引入杂质的角度考虑,可以采用加入ZnO来调节pH;
②由题意知,KMnO4 溶液氧化Fe2+,生成MnO2和Fe(OH)3。若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:硝酸被还原,生成氮的氧化物;
(2)①滤渣 B 的主要成分为MnO2和Fe(OH)3;
②滤液B中如果含有铁元素,则为Fe3+,所以应使用KSCN溶液;
③用Zn处理的是Cu2+,所以生成滤渣C应为Cu;
(3)从表中数据看,实验3的数据为失真数据,前两次实验中,K4Fe(CN)6 溶液的体积平均为19.8mL。设样品中含ZnSO4·7H2O晶体的纯度为x

![]()
(1)①从表1可以看出,pH=4时,杂质含量最少,且ZnSO4.7H2O 回收量相对较多;温度60℃时,总体看,杂质含量最少,且ZnSO4.7H2O 回收量相对较多;从不引入杂质的角度考虑,可以采用加入ZnO来调节pH;答案为:4,60oC;ZnO;
②由题意知,KMnO4 溶液氧化Fe2+,生成MnO2和Fe(OH)3,然后利用电子守恒、质量守恒进行配平,即得MnO4- + 3Fe2+ + 7H2O = MnO2↓+ 3Fe(OH)3↓+ 5H+。若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:硝酸被还原,生成氮的氧化物;答案为:MnO4- + 3Fe2+ + 7H2O = MnO2↓+ 3Fe(OH)3↓+ 5H+;产生氮氧化合物污染环境;
(2)①滤渣 B 的主要成分为MnO2和Fe(OH)3;答案为:氢氧化铁、二氧化锰;
②滤液B中如果含有铁元素,则为Fe3+,所以应使用KSCN溶液;答案为:在试管中取少量滤液B,滴加2滴KSCN溶液,若溶液变红则有铁元素,不变红则无铁元素;
③用Zn处理的是Cu2+,所以生成滤渣C应为Cu,反应的离子方程式为Zn + Cu2+ == Zn2+ + Cu;答案为:Zn + Cu2+ == Zn2+ + Cu;
(3)从表中数据看,实验3的数据为失真数据,前两次实验中,K4Fe(CN)6 溶液的体积平均为19.8mL。设样品中含ZnSO4·7H2O晶体的纯度为x

![]() 。答案为:85.24%。
。答案为:85.24%。


 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如图:

已知:HCHO+RCH2CHO![]()
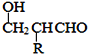
![]()
![]()
请据此回答:
(1)A中含氧官能团名称是________________,C的系统命名为_____________________ 。
(2)检验B中所含官能团所用的试剂有______________、_____________;E→F的反应类型是______________,B+D![]() E的反应类型是______________________。
E的反应类型是______________________。
(3)写出A→B的化学方程式__________________________________________________。
(4)写出C→D的化学方程式__________________________________________________。
(5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备![]() 的合成路线_______________________________________________________________
的合成路线_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。
请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
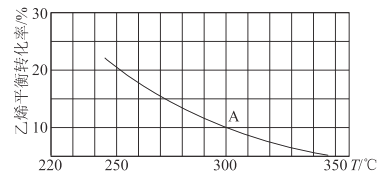
①该反应为____热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素
B.在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C.某基态原子的核外电子排布图为![]() ,它违背了泡利原理
,它违背了泡利原理
D.某价电子排布为3d14s2的基态原子,该元素位于周期表中第四周期第ⅢB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、物质变化观念是化学学科核心素养之一。已知a、b、c、d、e五种物质的相互转化关系如图所示,其中a、d、e为常见的单质,b、c为化合物。
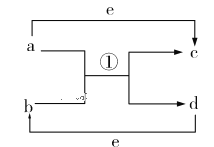
(1)若a、d为短周期非金属单质,且a、d所含元素同主族,a、e所含元素在不同周期。则b、c的沸点:b_________c(填“<”“>”或“=”);a和b反应生成两种氧化物的化学方程式为_________________。
(2)若a是常见的金属单质,点燃发出耀眼白光。d为固态非金属单质,熔点很高,其某种形态单质硬度极大,e为常见的气体单质,则a和b反应的化学方程式为________________________________。
(3)若a、d为常见的金属单质,它们与浓硝酸在加热条件下才能顺利反应。a既可以与强酸反应也可以与强碱反应,d在e中燃烧可以生成b。则足量的d与稀硝酸反应的离子方程式为__________________________________________。
Ⅱ、HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(4)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2)则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填字母)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(5)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用Na2O2设计装置验证某些物质的性质。甲组:在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
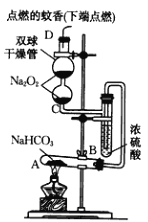
(1)在A试管内发生反应的化学方程式是__。
(2)B装置的作用是__。
(3)在双球干燥管内发生反应的化学方程式__,当有1molNa2O2发生反应,转移电子数目为__;双球干燥管内观察到的实验现象是__。
(4)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
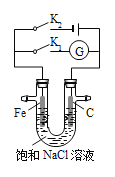
A.K1闭合,K2打开,铁棒上发生的反应为2Cl2e== Cl2↑
B.K1闭合,K2打开,石墨棒周围溶液pH逐渐减小
C.K1打开,K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K1打开,K2闭合,电路中通过0.002 mol电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铜粉与下列试剂的反应,在试管中加入一定量铜粉,加入试剂后,立即塞上橡胶塞,实验现象如下表所示,下列推断不正确的是( )
资料:Cu2++4NH3![]() [Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
[Cu(NH3)4]2+, [Cu(NH3)4]2+呈绛蓝色。
装置 | 序号 | 试剂 | 现象 |
| ① | 10 mL浓NH3·H2O,3 mLH2O | 溶液变为绛蓝色,左侧水柱上升 |
② | 10 mL浓NH3·H2O,3 mL H2O2 | 溶液变为绛蓝色,且比①深 | |
③ | 10 mL 20% HNO3溶液,3 mL H2O | 溶液快速变蓝,产生无色气体,左侧水柱下降 | |
④ | 10 mL 20% HNO3溶液,3 mL H2O2 | 溶液变蓝比③慢,产生无色气体,左侧水柱下降 |
A.①中实验现象说明O2参与了反应
B.②中溶液颜色比①深可能是由于H2O2氧化Cu生成Cu2+
C.③中左侧水柱下降可能是反应产生NO气体导致的
D.④比③变蓝慢是由于H2O2分解造成自身消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学设计并进行了如下实验,以探究乙炔与溴的加成反应:先取一定量工业用电石与水反应,将生成的气体通入足量的溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色的溶液里有少许黄色浑浊,推测在制得乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中的两个化学方程式:_______________、____________。
(2)乙认为甲设计的实验不能验证此反应为加成反应,其理由是________________。
A.使溴水褪色的物质,就是乙炔
B.使溴水褪色的反应就是加成反应
C.使溴水褪色的物质,未必是乙炔
D.使溴水褪色的反应未必是加成反应
(3)乙同学推测此乙炔中必定含有的一种杂质气体是_________,在验证过程中必须全部除去,它与溴水反应的化学方程式是________________________________________________________。
(4)请你选用下列三个装置(见下图)(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
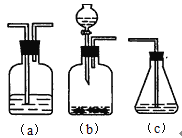
![]()
___、___、___、___
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com