
 实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:分析 (1)根据配制一定物质的量浓度溶液用到仪器选择;根据配制溶液的体积选择容量瓶的规格;
(2)依据容量瓶构造解答;
(3)容量瓶为配制特定体积的一定物质的量浓度专用仪器,不能稀释浓溶液、不能用于溶解固体、储存溶液,不能作为反应容器等;
(4)依据m=CVM计算需要溶质的质量;依据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释溶质的物质的量不变计算需要浓硫酸体积,分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有烧瓶和分液漏斗,
要配置450mL溶液应选择500mL容量瓶,所以还缺少的仪器:烧杯、玻璃棒;
故答案为:AC;烧杯、玻璃棒;
(2)容量瓶上标有:温度、容量、刻度线;
故选:①③⑤;
(3)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,不能用来长期存储液体,
故选:BCE;
(4)需要0.1mol/LNaOH溶液450ml,应选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量m=0.1mol/L×0.5L×40g/mol=2.0g;
质量分数为98%、密度为1.84g/mL的浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释溶质的物质的量不变计算得:18.4mol/L×V=0.51mol/L×500mL,解得V=13.9mL;
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,冷却后溶液体积偏小,溶质的物质的量浓度偏高,故选;
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故不选;
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
④定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;
故答案为:2.0; 13.9;①④.
点评 本题主要考查一定物质的量浓度溶液的配制与稀释,注意容量瓶、量筒规格的选取方法及使用注意事项,注意误差分析的方法为易错点,难度不大,


科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中肯定不含非极性共价键 | B. | 原子晶体的熔点肯定高于其他晶体 | ||
| C. | 由分子组成的物质其熔点一定较低 | D. | 构成晶体的粒子一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | 工业固氮N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{71ρ}{32}$g•L-1 | B. | $\frac{32ρ}{71}$g•L-1 | C. | $\frac{32}{71ρ}$g•L-1 | D. | $\frac{71}{32ρ}$g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
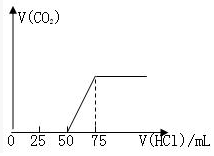 有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?
有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后向溶液中逐滴加入0.1mol•L-1的盐酸,产生的CO2气体体积(标准状况下)与所加入的盐酸的体积之间的关系如图所示:试分析向NaOH溶液中通入CO2气体后,所得溶液中的溶质是什么?其物质的量之比是多少?产生的CO2气体体积(标准状况)是多少?查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯是一种强碱,比KOH的碱性强 | |
| B. | 铯与水或酸溶液反应剧烈,都生成氢气 | |
| C. | Cs的还原性比Na强,故Na+的氧化性大于Cs+ | |
| D. | Al的金属性大于Cs的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
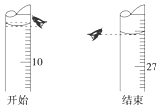 某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | V1 | V2 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com