
| A. | H3PO4?3H++PO43- | B. | BaSO4?Ba2++SO42- | ||
| C. | Al(OH)3?H2O+AlO2-+H+ | D. | NaHS?Na++H++S2- |
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式.方程式左边写化学式,右边写离子,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开,强电解质用=连接,弱电解质用?连接,
A.磷酸为多元弱酸应分步电离;
B.硫酸钡为强电解质,应用=连接;
C.氢氧化铝为两性化合物,该选项书写的是酸式电离;
D.氢硫酸为弱酸,硫氢根离子不能拆写,且应用=连接.
解答 解:A.H3PO4为多元弱酸,部分电离,电离方程式为:H3PO4?H++H2PO4-,H2PO4-?H++HPO42-,HPO42-?H++HPO43-,故A错误;
B.硫酸钡为盐,属于强电解质,完全电离,电离方程式为:BaSO4=Ba2++SO42-,故B错误;
C.氢氧化铝为两性化合物,酸式电离:Al(OH)3?H2O+AlO2-+H+,故C正确;
D.NaHS是多元弱酸的酸式盐的酸根离子,不能拆分,电离方程式为:NaHS=Na++HS-,故D错误.
故选C.
点评 本题考查了电离方程式的书写判断,掌握正确书写电离方程式的方法,并会正确判断电离方程式的正误是解题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇在该反应中表现为氧化性 | B. | 反应中Cr元素被还原 | ||
| C. | 该反应不是氧化还原反应 | D. | 该反应时复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
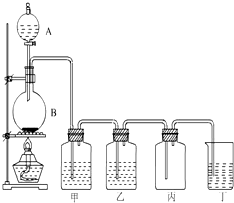 如图为实验室制取氯气的装置图,请根据该图回答下列问题.
如图为实验室制取氯气的装置图,请根据该图回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 氯化铁溶液中滴入苯酚的水溶液后,溶液呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.
如图所示一套实验装置来制取乙酸乙酯,A中盛有乙醇、浓硫酸和醋酸的混合液,C中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 117.9 | 77.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com