
 向容积固定的容器甲和带有活塞的定压容器乙中分别通入2mol SO2和1mol O2(如下图),若开始通气时两容器的体积相同,在相同温度下反应,一段时间后,反应达到平衡.则下列说法正确的是( )
向容积固定的容器甲和带有活塞的定压容器乙中分别通入2mol SO2和1mol O2(如下图),若开始通气时两容器的体积相同,在相同温度下反应,一段时间后,反应达到平衡.则下列说法正确的是( )| A. | 平衡时,两容器内SO3的浓度必定相等 | |
| B. | 平衡时,混合气体中的SO3的体积分数甲比乙高 | |
| C. | SO2的转化率乙容器内比甲容器内高 | |
| D. | 反应后的相同时间内,甲容器中的反应速率大 |
分析 甲容器保持恒容,乙容器保持恒压,由于反应前后的气体系数和不等,所以两个平衡态也不一样,甲容器达到平衡后体系压强减小,乙容器中保持恒压,反应达到平衡过程中压强大于甲容器,平衡正向进行;
A、两容器达到平衡后压强不等,而起始量是相等的,所以平衡时两容器内SO3的浓度必定不相等;
B、甲容器达到平衡后压强减小,乙容器中保持恒压,反应达到平衡过程中压强大于甲容器,平衡正向进行;
C、达到平衡时甲的压强小于乙,所以甲中反应正向进行的程度小于乙;
D、反应中压强大,反应速率快,据此判断.
解答 解:A、两容器达到平衡后压强不等,而起始量是相等的,所以平衡时两容器内SO3的浓度必定不相等,故A错误;
B、甲容器达到平衡后压强减小,乙容器中保持恒压,反应达到平衡过程中压强大于甲容器,平衡正向进行,所以混合气体中的SO3的体积分数甲比乙低,故B错误;
C、达到平衡时甲的压强小于乙,所以甲中反应正向进行的程度小于乙,所以SO2的转化率乙容器内比甲容器内高,故C正确;
D、反应中压强大,反应速率快,所以甲容器中的反应速率小,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,题目难度不大,注意计较两容器的不同状态,从压强对平衡移动的影响角度分析.


科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
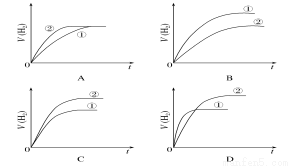
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列实验操作、现象及由此得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铜粉加入1.0 mol·L-1Fe2(SO4)3溶液中 | 铜粉溶解 | 金属铜比铁活泼 |
B | 将pH试纸放在玻片上,用玻璃棒蘸取某新制氯水,点在pH试纸中央,与标准比色卡对照 | pH=2 | 氯气与水反应生成了强酸 |
C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
D | 将KI和FeCl3溶液在试管中混合后,加入汽油,振荡,静置 | 下层溶液显紫红色 | 生成的I2全部溶于汽油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
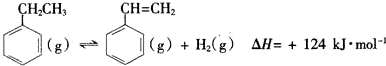
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | x | 436 |
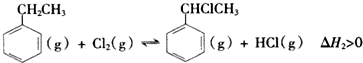
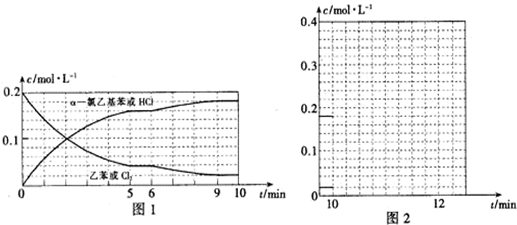
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 大量的汽车尾气是造成雾霾天气的一个重要因素 | |
| D. | 煤的液化和气化均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融NaHSO4电离出的阳离子与阴离子之比 | |
| B. | 0.2mol•L-1的CH3COOH溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 | |
| D. | pH=12的Ba(OH)2溶液与pH=12的KOH溶液中c(OH-)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
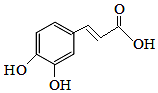
| A. | 能发生加聚反应 | |
| B. | 能与碳酸钠溶液反应 | |
| C. | 1 mol咖啡酸最多能与3 mol NaOH反应 | |
| D. | 1 mol咖啡酸最多能与 3 mol Br2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氖原子的相对原子质量是12$\frac{a}{b}$ | B. | 该氖原子的摩尔质量是aNAg | ||
| C. | Wg该氖原子的物质的量是$\frac{W}{{a{N_A}}}$mol | D. | Wg该氖原子所含质子数是10W/a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com