
 用系统命名法命名该烃:2,3-二甲基戊烷.
用系统命名法命名该烃:2,3-二甲基戊烷.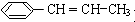 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: .
. .
. 分析 (1)有机物主链含有5个C原子,有2个甲基,分别位于2、3碳原子上;
(2)乙醇在铜催化剂存在下被氧气氧化生成乙醛和水;
(3)苯丙烯含有碳碳双键,可发生加聚反应生成聚苯乙烯;
(4)苯与浓硝酸在浓硫酸作催化剂条件下生成硝基苯.
解答 解:(1)有机物主链含有5个C原子,有2个甲基,分别位于2、3碳原子上,烷烃的名称为2,3-二甲基戊烷,
故答案为:2,3-二甲基戊烷;
(2)乙醇中含-OH,能发生催化氧化生成乙醛,该反应为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)苯丙烯中含C=C,可发生加聚反应,该加聚反应为 ,
,
故答案为: ;
;
(4)苯与浓硝酸在浓硫酸作催化剂的条件下生成硝基苯和水,化学反应方程式为: ,
,
故答案为: .
.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重乙醇、苯、烯烃性质的考查,注意发生的反应类型,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 锌片溶解了1mol,铜片上析出1mol氢气 | |
| B. | 锌片发生还原反应 | |
| C. | 正极附近的SO42-离子浓度逐渐增大 | |
| D. | 电池工作时,电子由正极通过外电路流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在高温条件下进行反应 | B. | 在有氧条件下进行反应 | ||
| C. | 按化学式计量投入原料 | D. | 隔绝氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为24 | |
| B. | 最高价氧化物为SeO3,为酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物分子式为H2Se,性质不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定含有乙烯 | B. | 混合气体中一定含有甲烷 | ||
| C. | 混合气体中一定含有丙烯 | D. | 混合气体中可能含有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验中,温度计水银球应位于蒸馏烧瓶中液面以下 | |
| B. | 制备乙酸乙酯的实验中,导管末端要伸入饱和Na2CO3溶液液面下 | |
| C. | 分液操作中,待下层液体流出后,将上层液体从分液漏斗上口倒出 | |
| D. | 测定溶液pH时,可用pH试纸蘸取少量待测液并与标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
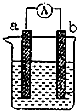 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
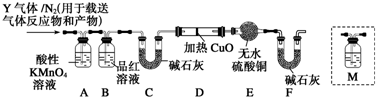
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸溶液和氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 氯化钠溶液中加入足量硝酸银溶液:Ag++Cl-=AgCl↓ | |
| D. | 氯化铁溶液中加入氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com