
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl- | |
| D. | 只含有共价键的物质一定是共价化合物 |
分析 A.碘离子还原性强于二价铁离子,硝酸根离子也能够氧化碘离子;
B.氯化铵为离子化合物;
C.次氯酸根离子具有强的氧化性能够氧化二氧化硫;
D.只含有共价键的化合物是共价化合物.
解答 解:A.向Fe(NO3)2和KI混合溶液中加入少量稀盐酸,酸性环境下硝酸根离子先氧化碘离子,再氧化二价铁离子,故A错误;
B.非金属元素形成的化合物不一定是共价化合物,如氯化铵为 非金属元素组成离子化合物,故B错误;
C.少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故C正确;
D.只含有共价键的物质不一定是共价化合物,如氢气、氯气,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意硝酸根离子在酸性环境下的强氧化性,共价化合物与离子化合物区别,题目难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 乙醇(乙酸) | KOH溶液 | 分液 |
| C | 苯(苯酚) | NaOH溶液 | 分液 |
| D | 甲烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| U | ||
| Y |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中;2n(H2A)+n(A2-)=0.002mol | |
| B. | b点所得溶液中:c(H2A)+c(H+)=c(A2-)+e(OH-) | |
| C. | C点所得溶液中:c(Na+)<3c(HA-) | |
| D. | d点所得溶液中:c(Na+)>c(A2-)>c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫化钠加入水中S2-+2H2O═H2S+2OH- | |
| C. | 冰醋酸加入水中CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 铁与水蒸气反应2Fe+3H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
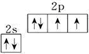 ,氧的第一电离能在同周期元素中由大到小排第4位.
,氧的第一电离能在同周期元素中由大到小排第4位.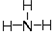 .
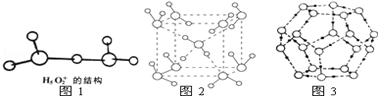
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不粘锅的内壁有聚四氟乙烯涂层,它不能使酸性高锰酸钾溶液褪色 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,两者互为同分异构体,且水解最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com