
| ÅØ¶Č | c£ØNH3£©£Ømol/L£© | c£ØO2£©£Ømol/L£© | c£ØNO£©£Ømol/L£© |
| ĘšŹ¼ | 0.8 | 1.6 | 0 |
| µŚ2min | 0.6 | a | 0.2 |
| µŚ4min | 0.3 | 0.975 | 0.5 |
| µŚ6min | 0.3 | 0.975 | 0.5 |
| µŚ8min | 0.7 | 1.475 | 0.1 |
·ÖĪö £Ø1£©ŅŃÖŖĒāĘųµÄČ¼ÉÕČČĪŖ285.8 kJ/mol£¬Ōņ¢Ł2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H=-285.8”Į2 kJ/mol=-571.6kJ/mol£¬ÓÖÖŖ¢ŚN2£Øg£©+3H2£Øg£©=2NH3£Øg£©”÷H=-92.4 kJ/mol£»¢ŪN2£Øg£©+O2£Øg£©=2NO£Øg£©”÷H=+180.6 kJ/mol£¬ĄūÓĆøĒĖ¹¶ØĀÉ£¬½«¢Ł”Į3-¢Ś”Į2+¢Ū”Į2æɵĆ4NH3£Øg£©+5O2£Øg£©?4NO£Øg£©+6 H2O£Øl£©£¬½ų¶ųæɼĘĖć·“Ó¦ČČ£¬ŅŌ“Ė½ā“š£»
£Ø2£©¢Ł·“Ó¦ŌŚµŚ2minµ½µŚ4minŹ±ŅĄ¾ŻĶ¼±ķŹż¾ŻæÉÖŖĻūŗÄ°±Ęų0.2mol/L£¬ŅĄ¾Ż»Æѧ·“Ó¦ĖŁĀŹv=$\frac{”÷c}{”÷t}$¼ĘĖć°±ĘųµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹ£»ŌŁøł¾ŻĶ¬Ņ»»Æѧ·“Ó¦Ķ¬Ņ»Ź±¼ä¶ĪÄŚ£¬ø÷ĪļÖŹµÄ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ¼ĘĮæŹżÖ®±Č¼ĘĖćŃõĘųµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹ£»
¢Śøł¾ŻĪļÖŹµÄÅØ¶Č±ä»ÆÅŠ¶Ļ·“Ó¦·½Ļņ£»
¢ŪÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ø÷×é·ÖÅØ¶Č²»±ä£¬ĖµĆ÷“ļµ½Ę½ŗāדĢ¬£¬ÓÉ“Ė·ÖĪöø÷Ń”Ļī£»
£Ø3£©¢ŁŌŚCH2=CH2Č¼ĮĻµē³ŲÖŠ£¬Č¼ĮĻCH2=CH2×÷øŗ¼«£¬·¢ÉśŹ§µē×ÓµÄŃõ»Æ·“Ó¦£»
¢ŚCH2=CH2×÷øŗ¼«£¬Ź§µē×Ó·¢ÉśĘų»Æ·“Ó¦£»
¢Ūøł¾Żµē½ā³ŲµÄ¹¤×÷ŌĄķŗĶĖ«Ė®½āŌĄķÖŖŹ¶Ą“»Ų“š£®
½ā“š ½ā£ŗŅŃÖŖĒāĘųµÄČ¼ÉÕČČĪŖ285.8 kJ/mol£¬Ōņ¢Ł2H2£Øg£©+O2£Øg£©=2H2O£Øl£©”÷H=-285.8”Į2 kJ/mol=-571.6kJ/mol£¬ÓÖÖŖ¢ŚN2£Øg£©+3H2£Øg£©=2NH3£Øg£©”÷H=-92.4 kJ/mol£»¢ŪN2£Øg£©+O2£Øg£©=2NO£Øg£©”÷H=+180.6 kJ/mol£¬ĄūÓĆøĒĖ¹¶ØĀÉ£¬½«¢Ł”Į3-¢Ś”Į2+¢Ū”Į2æɵĆ4NH3£Øg£©+5O2£Øg£©?4NO£Øg£©+6 H2O£Øl£©£¬”÷H=£Ø-571.6kJ/mol£©”Į3+6-£Ø-92.4 kJ/mol£©”Į2+£Ø+180.6 kJ/mol£©”Į2=-1168.8kJ/mol£¬
¹Ź“š°øĪŖ£ŗ-1168.8kJ/mol£»
£Ø2£©¢Ł°±ĘųµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖv=$\frac{”÷c}{”÷t}$=$\frac{£Ø0.6000-0.3000£©mol/L}{2min}$=0.015 mol/L£®min£¬Ķ¬Ņ»»Æѧ·“Ó¦Ķ¬Ņ»Ź±¼ä¶ĪÄŚ£¬ø÷ĪļÖŹµÄ·“Ó¦ĖŁĀŹÖ®±ČµČÓŚ¼ĘĮæŹżÖ®±Č£¬ĖłŅŌŃõĘųµÄĘ½¾ł»Æѧ·“Ó¦ĖŁĀŹĪŖ0.1875mol/L£®min£®
¹Ź“š°øĪŖ£ŗ0.1875mol/£ØL•min£©£»
¢ŚĶØĶعżĶ¼±ķÖŖ£¬·“Ó¦ĪļÅضČŌö“ó£¬Éś³ÉĪļÅØ¶Č¼õŠ”£¬ĖłŅŌĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬¼“Ļņ×óŅĘ¶Æ£¬
A£®Ź¹ÓĆ“ß»Æ¼Į£¬Ę½ŗā²»ŅĘ¶Æ£¬¹Ź“ķĪó£»
B£®ÉżøßĪĀ¶Č£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬·“Ó¦ĪļÅضČŌö“ó£¬Éś³ÉĪļÅØ¶Č¼õŠ”£¬¹ŹÕżČ·£»
C£®¼õŠ”Ń¹Ē棬·“Ó¦ĪļÅØ¶Č¼õŠ”£¬Éś³ÉĪļÅØ¶Č¼õŠ”£¬¹Ź“ķĪó£»
D£®Ōö¼ÓO2µÄÅØ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¹Ź“ķĪó£»
¹ŹŃ”£ŗB£»
¢ŪA£®µ„Ī»Ź±¼äÄŚÉś³Én mol NOµÄĶ¬Ź±£¬µČŠ§ÓŚĻūŗÄn mol NH3µÄĶ¬Ź±Éś³Én mol NH3£¬¹ŹÕżČ·£»
B£®Ģõ¼žŅ»¶Ø£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ£¬ĖµĆ÷ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
C£®°Ł·Öŗ¬Įæw£ØNH3£©=w£ØNO£©£¬¶ų²»ŹĒ²»±äµÄדĢ¬£¬²»Ņ»¶ØĘ½ŗā£¬¹Ź“ķĪó£»
D£®Ö»ŅŖ·“Ó¦·¢Éś·“Ó¦ĖŁĀŹ¾Ķ·ūŗĻv£ØNH3£©£ŗv£ØO2£©£ŗv£ØNO£©£ŗv£ØH2O£©=4£ŗ5£ŗ4£ŗ6£¬ĖłŅŌ²»Ņ»¶ØĘ½ŗā£¬¹Ź“ķĪó£»
E£®ČōŌŚŗćĪĀŗćŃ¹ĻĀČŻ»żæɱäµÄČŻĘ÷ÖŠ·“Ó¦£¬»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ±ä»Æ£¬ĖµĆ÷ĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓĮæ²»±ä£¬·“Ó¦“ļĘ½ŗāדĢ¬£¬¹ŹÕżČ·£»
¹ŹŃ”£ŗABE£»
£Ø3£©¢Łøł¾Ż×°ÖĆæÉŅŌÖŖµĄd“¦Éś³É“óĮæµÄĖ®£¬ĖłŅŌcµē¼«ŹĒĶØČėµÄŃõĘų£¬bæŚĶØČėµÄĪļÖŹĪŖC2H4£¬¹Ź“š°øĪŖ£ŗC2H4£»
¢Śd“¦Éś³É“óĮæµÄĖ®£¬ĖłŅŌcµē¼«ŹĒĶØČėµÄŃõĘų£¬ĪŖÕż¼«£¬·¢Éśµē¼«·“Ó¦ĪŖ£ŗO2+4e-+4H+=2H2O£¬øŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖ£ŗC2H4-12e -+4H2O=2CO2+12H+£¬
¹Ź“š°øĪŖ£ŗC2H4-12e -+4H2O=2CO2+12H+£»
¢ŪŌŚµē½ā³ŲÖŠ£¬½šŹōĀĮĪŖŃō¼«£¬·¢Éśµē¼«·“Ó¦£ŗAl-3e-=Al3+£¬ĀĮĄė×Ó»įŗĶĢ¼ĖįĒāøłĄė×ÓÖ®¼ä·¢ÉśĖ«Ė®½ā·“Ӧɜ³ÉĒāŃõ»ÆĀĮ³ĮµķŗĶ¶žŃõ»ÆĢ¼£¬¼“Al3++3HCO3-=Al£ØOH£©3”ż+3CO2”ü£¬ČÜŅŗÖš½„±ä»ė×Ē£¬¹Ź“š°øĪŖ£ŗAl-3e-=Al3+”¢Al3++3HCO3-=Al£ØOH£©3”ż+3CO2”ü£®
µćĘĄ ±¾Ģāæ¼²éĮĖøĒĖ¹¶ØĀɵÄÓ¦ÓĆ”¢·“Ó¦ĖŁĀŹµÄ¼ĘĖć”¢»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲ”¢Ę½ŗāדĢ¬µÄÅŠ¶Ļ”¢Ķ¼±ķŹż¾ŻÓ¦ÓĆÅŠ¶Ļ”¢Ōµē³ŲŌĄķµČ£¬ÄŃ¶Č½Ļ“ó£¬ÕĘĪÕĄķ½āøÅÄīŗĶÓŠ¹ŲŌĄķŹĒ½āĢā¹Ų¼ü£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¶žŃõ»Æ¹čÓėČĪŗĪĖį¶¼²»·“Ó¦ | |
| B£® | ¶žŃõ»ÆĢ¼ĶØČėĖ®²£Į§ÖŠÄܵƵ½¹čĖį³Įµķ | |
| C£® | ¹čµÄŠŌÖŹŗÜĪČ¶Ø£¬ÄÜŅŌµ„ÖŹŠĪŹ½“ęŌŚÓŚµŲæĒÖŠ | |
| D£® | ¶žŃõ»Æ¹čČÜÓŚĖ®ĻŌĖįŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĶĢõµÄÖĘ×÷æŚ¾÷ŹĒ”°Ņ»¼ī”¢¶ž·Æ”¢ČżĒ®ŃĪ”±£¬ĘäÖŠµÄ”°¼ī”±ŹĒÉÕ¼ī | |
| B£® | ŗŚ»šŅ©µÄ×īÓÅ»ÆÅä·½ŹĒ”°Ņ»Įņ¶žĻõČżÄ¾Ģæ”±£¬ĘäÖŠµÄ”°Ļõ”±ŹĒĻõĖį¼Ų | |
| C£® | ¹żĀĖ²Ł×÷ŅŖĮģŹĒ”°Ņ»Ģł¶žµĶČżææ”±£¬ĘäÖŠ”°Ģł”±ŹĒÖøĀĖÖ½½ōĢłĀ©¶·µÄÄŚ±Ś | |
| D£® | ”°¹ĢĢåŠč³×»ņÖ½²Ū£¬Ņ»ĖĶ¶žŹśČżµÆµÆ£»æé¹Ģ»¹ŹĒÄ÷×ÓŗĆ£¬Ņ»ŗį¶ž·ÅČżĀżŹś”°£®Ē°Ņ»øö¹ĢĢåŅ»°ćÖø·Ūĩד¹ĢĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÕāÖÖĮ£×ÓÖŠŗ¬ÓŠ3øöÖŹ×Ó | B£® | ĖüµÄ×é³ÉæÉÓĆH3±ķŹ¾ | ||
| C£® | ÕāÖÖĮ£×ÓÖŠŗ¬ÓŠ3øöÖŠ×Ó | D£® | ŹĒĒāµÄŅ»ÖÖŠĀµÄĶ¬Ī»ĖŲ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CuŗĶCu2OµÄĪļÖŹµÄĮæÖ®±ČĪŖ2£ŗ1 | |
| B£® | ²śÉśµÄNOŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ4.48L | |
| C£® | ĻõĖįµÄĪļÖŹµÄĮæÅضČĪŖ2.6mol•L-1 | |
| D£® | CuŗĶCu2OÓėĻõĖį·“Ó¦ŗóŹ£ÓąHNO3ĪŖ0.2mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
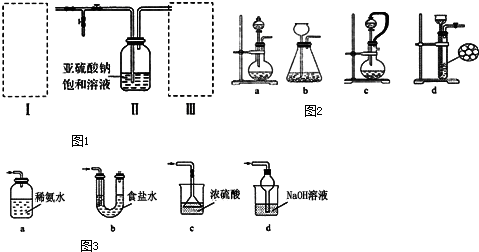
²éæ““š°øŗĶ½āĪö>>
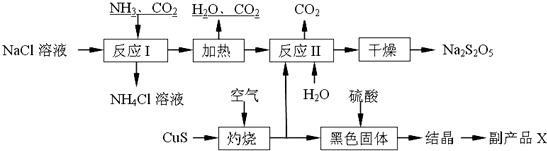
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½šŹōÄĘÓėĖ®·“Ó¦±Č½šŹōÄĘÓė¼×“¼·“Ó¦øü¾ēĮŅ | |
| B£® | ½įŗĻH+µÄÄÜĮ¦CH3O-£¼OH- | |
| C£® | ĖłµĆµ½ČÜŅŗÖŠK=c£ØCH3O-£©”Įc£ØCH3OH2+£© | |
| D£® | ĖłµĆµ½ČÜŅŗÖŠc£ØNa+£©+c£ØCH3OH2+£©ØTc£ØCH3O-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĮņĖį”¢“æ¼ī”¢Ź³ŃĪ | B£® | “×Ėį”¢ÉÕ¼ī”¢ÉśŹÆ»Ņ | ||
| C£® | ĻõĖį”¢ÉÕ¼ī”¢µØ·Æ | D£® | ŃĪĖį”¢ŹģŹÆ»Ņ”¢Ńõ»ÆĆ¾ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com