
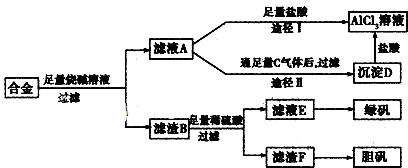

分析 含有铝、铁、铜的合金加入氢氧化钠溶解,只有铝与氢氧化钠反应生成偏铝酸钠和氢气,所以滤渣B为铁和铜,再经稀硫酸反应过滤的滤液为氯化亚铁,进一步转化成绿矾,滤渣F为铜单质,进一步转化成胆矾;滤液A则为偏铝酸钠溶液,加过量盐酸经途径Ⅰ生成氯化铝溶液,而滤液A通足量气体C经途径Ⅱ生成沉淀D,根据氢氧化铝只溶于强酸强碱,所以气体C为二氧化碳,沉淀D为氢氧化铝,与盐酸反应生成氯化铝溶液,
(1)根据以上分析,该流程需要过滤操作,所以还需的玻璃仪器为玻璃棒、漏斗;
(2)根据反应所得产物的组成来选择合适的制取方案;根据所发生的反应来确定溶液的组成情况,并书写发生的反应;
(3)根据实验中的酸和碱的量的情况来对比回答;
(4)铜与稀硝酸反应生成硝酸铜与一氧化氮,SO2尾气水溶液为酸性,利用碱液吸收即可.
解答 解:含有铝.铁.铜的合金加入氢氧化钠溶解,只有铝与氢氧化钠反应生成偏铝酸钠和氢气,所以滤渣B为铁和铜,再经稀硫酸反应过滤的滤液为氯化亚铁,进一步转化成绿矾,滤渣F为铜单质,进一步转化成胆矾;滤液A则为偏铝酸钠溶液,加过量盐酸经途径Ⅰ生成氯化铝溶液,而滤液A通足量气体C经途径Ⅱ生成沉淀D,根据氢氧化铝只溶于强酸强碱,所以气体C为二氧化碳,沉淀D为氢氧化铝,与盐酸反应生成氯化铝溶液;
(1)根据以上分析,该流程需要过滤操作,所以还需的玻璃仪器为漏斗、玻璃棒、酒精灯,故答案为:漏斗、玻璃棒、酒精灯;
(2)途径Ⅰ偏铝酸钠和过量的盐酸反应生成氯化铝和氯化钠的混合物,而途径Ⅱ向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,再用盐酸溶解,所得溶液的成分只有氯化铝,所以途径Ⅱ更合理;铝、铁、铜的合金中只有金属铝可以和强碱反应生成偏铝酸钠和氢气,所以滤液A的成分是偏铝酸钠,可以和过量的二氧化碳反应生成氢氧化铝和碳酸氢钠,实质为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:Ⅱ;途径I制得的AlCl3 溶液中含有大量的NaCl,而途径Ⅱ能制得纯净的AlCl3溶液;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;
(3)在实验方案一中,酸的量的控制上没有过高的要求,只需过量即可,但是方案二中,需要的是适量的酸,这很难控,故答案为:否;后者操作步骤多,消耗试剂量大,实验时间长;
(4)向滤渣中加入稀H2SO4和KNO3的混合溶液,发生的离子反应为3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,SO2尾气水溶液为酸性,利用NaOH溶液吸收,d装置可以防止倒吸现象,故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;d.
点评 本题是对物质的分离和提纯知识点的考查,题目难度不是很大,可以根据所学的知识进行.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液不产生沉淀,再加入硝酸银溶液,有不溶于稀硝酸的白色沉淀生成,可判定含有Cl- | |
| B. | 先加稀盐酸酸化,无沉淀生成,再加BaCl2溶液,产生白色沉淀,可判定含有SO42- | |
| C. | 加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+ | |
| D. | 加入盐酸后有无色、无味气体逸出,此气体能使澄清石灰水变浑浊,可判定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
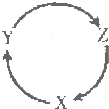 下表各组物质中,满足下图物质一步转化关系的选项是( )
下表各组物质中,满足下图物质一步转化关系的选项是( )| X | Y | Z | |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | Cl2 | HCl | NaCl |
| D | Si | SiO2 | H3SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com