
���� ��1������C��Ũ�ȱ仯���C�ķ�Ӧ���ʣ������A�����ʣ���ϻ�ѧ����ʽ������ϵ��������B���ʵ����õ�ƽ��״̬B���ʵ���������Ũ�ȣ�
��2�����ݸ÷�Ӧ���ص㣺��Ӧǰ������������䣬��Ӧ�������������٣������жϣ�ƽ���־�����淴Ӧ������ͬ������ɺ������ֲ��估�����������������������
��� �⣺��1��5min��Ӧ�ﵽƽ��ʱC��Ũ��Ϊ1.2mol/L������C���ʵ���=1.2mol/L��2L=2.4mol����Ӧ����v��C��=$\frac{1.2mol/L}{5min}$=0.24mol/L•min����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�v��A��=$\frac{2}{3}$v��C��=$\frac{2}{3}$��0.24mol/��L•min��=0.16mol/��L•min������ӦB���ʵ���=$\frac{2.4mol}{3}$=0.8mol��ƽ��״̬��ʣ��B���ʵ���=1mol-0.8mol=0.2mol��Ũ��=$\frac{0.2mol}{2L}$=0.1mol/L��
�ʴ�Ϊ��0.16mol/��L��min����0.1mol/L��
��2��A��DΪ���壬��Ӧǰ���������������ı䣬���û����������������ж�ƽ�⣬��A��ȷ��
B����Ӧǰ������������䣬��Ӧ�������������٣����������ܶȼ�С���������ܶ��жϣ���B��ȷ��
C��DΪ���壬Ũ��Ϊ�����������жϷ�Ӧ�Ƿ�ƽ�⣬��C����
D����Ӧǰ�����������仯�����ʵ������䣬���Ի�������ƽ����Է����������ٸı䣬�����жϷ�Ӧ�ﵽƽ�⣬��D��ȷ��
�ʴ�Ϊ��ABD��
���� ���⿼���˷�Ӧ���ʵļ��㡢ƽ��״̬���жϡ�ƽ���ƶ�Ӱ�����ط�����Ҫע������֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ���Ŀ�ϼ�


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
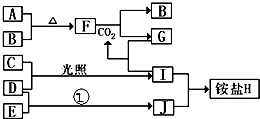 ��ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯���������Һ����ת����ϵ����֪B��C��D��E�Ƿǽ����������ڳ��³�ѹ�¶������壻������G����ɫ��ӦΪ��ɫ��������I��Jͨ��״���³���̬����Ӧ���ǻ��������е�һ�̵ֹ���Ӧ��
��ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯���������Һ����ת����ϵ����֪B��C��D��E�Ƿǽ����������ڳ��³�ѹ�¶������壻������G����ɫ��ӦΪ��ɫ��������I��Jͨ��״���³���̬����Ӧ���ǻ��������е�һ�̵ֹ���Ӧ��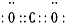 ��
�� 2NH3�Ļ�ѧ����ʽ��
2NH3�Ļ�ѧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
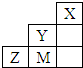
| A�� | �ǽ����ԣ�Y��M��Z | |
| B�� | Y��Z��M���⻯����Ӹ�ԭ������������8e-�ȶ��ṹ | |
| C�� | ԭ�Ӱ뾶��M��Z��Y | |
| D�� | Y ������������ˮ����Ļ�ѧʽΪHYO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  �������� | B�� |  ����K2CO3�е�K+ | ||
| C�� |  �ռ�������NH3������ | D�� |  �Ʊ�Fe��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ���� | T/K | ��������/g | KMnO4������ҺŨ��mol/L | ʵ��Ŀ�� |
| �� | 298 | 0.5 | 0.01 | ����ʵ��ٺ͢�̽��KMnO4������Һ��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� ����ʵ��ٺ͢�̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻 ����ʵ��ٺ͢�̽�������Ը÷�Ӧ���ʵ� Ӱ�죻 |
| �� | ||||
| �� | 323 | |||
| �� |
| KMnO4������Һ��Ũ��/mol•L-1 | ��Һ��ɫ����ʱ�� t/min | ||
| ��1�� | ��2�� | ��3�� | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ��һ��ij��ѧС��Ϊ�Ƚ�����ʹ�������ԣ����������ʵ�鷽����װ����ͼ��
ʵ��һ��ij��ѧС��Ϊ�Ƚ�����ʹ�������ԣ����������ʵ�鷽����װ����ͼ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 68.3% | B�� | 74.2% | C�� | 92.2% | D�� | 78.1% |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com