
| A. | 用惰性电极电解饱和食盐水,若电路中通过NA个电子,则阴极一定产生11.2LCl2 (标况) | |
| B. | lmolCH3COOC2H5在稀硫酸溶液中受热水解可得到乙醇分子数为NA | |
| C. | 含NA个Na+的Na2O2溶解于水配成2L溶液,所得溶液中Na+的物质的量浓度为0.5mol/L | |
| D. | 足量的MnO2固体与1L12mol/L的浓盐酸加热时反应,生成Cl2的分子数为3NA |
分析 A.电解饱和食盐水时,阴极上是氢离子发生得电子的还原反应,生成氢气;
B.酯的水解反应为可逆反应,不能进行到底;
C.据c=$\frac{n}{V}$据此进行计算;
D.1L12mol/L浓盐酸与足量的MnO2加热反应,随反应进行浓盐酸浓度减小,变稀后不与二氧化锰反应生成氯气.
解答 解:A.电解饱和食盐水时,阴极上是氢离子发生得电子的还原反应,生成H2,则阴极一定产生Cl2错误,故A错误;
B.酯的水解反应为可逆反应,不能进行到底,所以1mol CH3COOC2H5在稀硫酸溶液中水解可得到乙醇分子数小于NA,故B错误;
C.n(Na+)=$\frac{N}{{N}_{A}}$=$\frac{{N}_{A}}{{N}_{A}}$=1mol,则c(Na+)=$\frac{n}{V}$=$\frac{1mol}{2L}$=0.5mol/L,故C正确;
D.1L12mol/L浓盐酸与足量的MnO2加热反应,随反应进行浓盐酸浓度减小,变稀后不与二氧化锰反应生成氯气,生成Cl2分子数小于0.3NA ,故D错误,
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意可逆反应特点、题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 天然气是可再生的清洁能源,可用于工业制盐酸 | |
| B. | SiO2、MgO、Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 硝酸铵属于氧化剂,严禁用可燃物(如纸袋)包装 | |
| D. | 纤维素属于多糖类物质,但不能作人类的营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C(s)+O2(g)═CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2 | |
| B. | S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H1 2H2(g)+O2(g)═2H2O(g)△H2 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H1 CaO(s)+H2O(l)═Ca(OH)2(s)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时电池反应式为FePO4+Li═LiFePO4 | |
| B. | 放电时在正极上是Li+得电子被还原 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 充电时动力电池上“+”的电极与外接电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a气体是氯气,b气体是氢气 | |
| B. | 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体 | |
| C. | ClO2发生器中的还原反应为:2ClO3-+12H++10e-═Cl2↑+6H2O | |
| D. | 氯化钠电解槽内每生成2 mol a气体,转移2mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )
短周期元素X、Y、Z.W的原子序数依次增大.在如图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物.常温时,0.1mol•L-1的a溶液的pH为1,d为红棕色气体,e为无色气体.下列说法正确的是( )| A. | 元素的非金属性:Y>Z>X | |
| B. | 反应①中消耗lmola时转移电子数与反应②中生成1mol a时转移电子数相等 | |
| C. | 原子半径的大小:y<Z<W | |
| D. | Y的氢化物常温常压下为气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子比例模型: | B. | 二 氧化硅的分子式:SiO2 | ||
| C. | 溴化铵的电子式: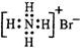 | D. | S2-离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com