

| (i)LiAlH4/乙 |
| (ii)H2O醚 |
| Cu/O2 |
| △ |
| (i)银氨溶液/△ |
| (ii)H+ |
| H2/Ni |
| △ |
| Br2/PBr3 |
| △ |
| (i)NaOH/H2O |
| (ii)H+ |
| 一定条件 |
| (i)LiAlH4/乙醚 |
| (ii)H2O |
| Br2/PBr3 |
| △ |
| 2×10+2-10 |
| 2 |
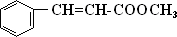 ,A发生信息中反应生成B为
,A发生信息中反应生成B为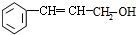 ,B发生催化氧化生成C为
,B发生催化氧化生成C为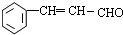 ,C与银氨溶液发生氧化反应生成D为
,C与银氨溶液发生氧化反应生成D为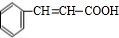 ,D与氢气发生加成反应生成E为
,D与氢气发生加成反应生成E为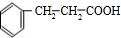 ,E在Br2/PBr3作用下得到F为
,E在Br2/PBr3作用下得到F为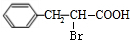 ,F发生水解反应并酸化得到G为
,F发生水解反应并酸化得到G为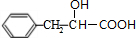 ,G发生缩聚反应得到H为
,G发生缩聚反应得到H为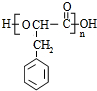 ,据此解答.
,据此解答.| 2×10+2-10 |
| 2 |
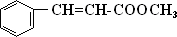 ,A发生信息中反应生成B为
,A发生信息中反应生成B为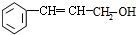 ,B发生催化氧化生成C为
,B发生催化氧化生成C为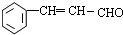 ,C与银氨溶液发生氧化反应生成D为
,C与银氨溶液发生氧化反应生成D为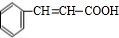 ,D与氢气发生加成反应生成E为
,D与氢气发生加成反应生成E为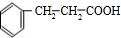 ,E在Br2/PBr3作用下得到F为
,E在Br2/PBr3作用下得到F为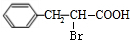 ,F发生水解反应并酸化得到G为
,F发生水解反应并酸化得到G为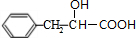 ,G发生缩聚反应得到H为
,G发生缩聚反应得到H为 ,
,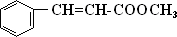 ,故答案为:
,故答案为: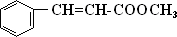 ;
;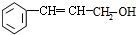 ,与Br2的CCl4溶液反应后的生成物为
,与Br2的CCl4溶液反应后的生成物为 ,溴原子连接的碳原子均连接4个不同的原子或原子团,均为为手性碳原子,故生成物中手性碳原子的数目为 2,故答案为:2;
,溴原子连接的碳原子均连接4个不同的原子或原子团,均为为手性碳原子,故生成物中手性碳原子的数目为 2,故答案为:2;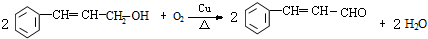 ,
,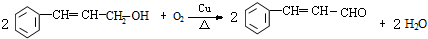 ;
;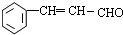 )的所有同分异构体:①分子中不含羰基和羟基;②是苯的对位二元取代物;③除苯环外,不含其他环状结构,含有碳碳双键与醚键,符合条件的结构简式为:
)的所有同分异构体:①分子中不含羰基和羟基;②是苯的对位二元取代物;③除苯环外,不含其他环状结构,含有碳碳双键与醚键,符合条件的结构简式为: 、
、 ,
, 、
、 ;
; ,
, ;
;

科目:高中化学 来源: 题型:
| 试管号 | 加入试剂 | 实验现象 | 离子方程式 |
| 1号 | 稀硫酸、H2O2、淀粉液 | 溶液立刻由褐色变成蓝色 | (1) |
| 2号 甲 | 新制的饱和氯水、1%淀粉液 | (2) | 2I-+Cl2=I2+2Cl- |
| 2号 乙 | 新制的饱和氯水、CCl4 | (3) | |
| 3号 | 食用碘盐、稀硫酸、1%淀粉液 | 溶液立刻由无色变成蓝色 | (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.50 | 31.50 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
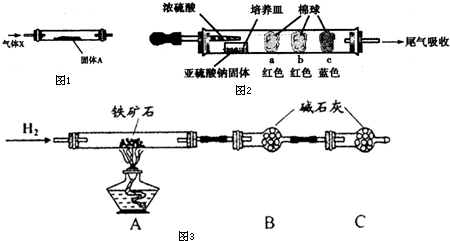
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 结论:该气体具有 |
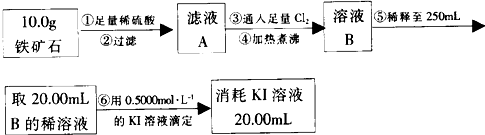
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧燃料电池在碱性介质中的负极反应式:H2-2e-=2H+ | ||||
B、用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O
| ||||
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | ||||
| D、用镀层金属作阳极、镀件作阴极,进行电镀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH逐渐减小 | ||||
B、
| ||||
| C、水的电离程度会不断增大 | ||||
| D、Kw不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com