
| A. | 3种 | B. | 6种 | C. | 9种 | D. | 12种 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 79、81 | B. | 45、46 | C. | 44、45 | D. | 44、46 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该温度下,Ksp (BaSO4 )=1.0×10-24 | |
| B. | a点的Ksp (BaSO4 )小于b点的Ksp (BaSO4 ) | |
| C. | d点表示的是该温度下BaSO4的不饱和溶液 | |
| D. | 加入BaCl2可以使溶液由 c点变到a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素最高价氧化物对应的水化物一定是强酸 | |
| B. | X元素氢化物的化学式一定为H2X | |
| C. | X的单质一定是良好的半导体材料 | |
| D. | X元素的氧化物一定能与烧碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2和H2的体积比为4:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
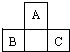 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则 ,A的氢化物分子式为H2O;
,A的氢化物分子式为H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com