
| A. | K2FeO4具有强氧化性,可用作水处理剂 | |
| B. | 氢氧化铝具有弱碱性,可用作制胃酸中和剂 | |
| C. | 碳具有还原性,可用作锌锰干电池的正极材料 | |
| D. | 常温下浓硫酸能使铝发生钝化,可用铝制容器贮运浓硫酸 |
分析 A.K2FeO4具有强氧化性,可用于消毒杀菌,被还原为Fe3+,水解生成Fe(OH)3,具有吸附性;
B.氢氧化铝具有弱碱性,能中和酸;
C.原电池的正极不发生反应;
D.常温下,浓硫酸遇到铝发生钝化.
解答 解:A.K2FeO4具有强氧化性,可用于消毒杀菌,被还原为Fe3+,水解生成Fe(OH)3,具有吸附性,可用于吸附水中的悬浮杂质,所以高铁酸钾作水处理剂具有净水功能,故A正确;
B.胃酸的主要成分是HCl,氢氧化铝具有弱碱性,能中和酸,二者有对应关系,故B正确;
C.碳可用作锌锰干电池的正极材料,不参加电池反应,只起导体作用,所以与还原性无关,故C错误;
D.常温下,浓硫酸遇到铝发生钝化,形成在致密氧化膜,阻止反应进行,所以可用铝制容器贮运浓硫酸,故D正确;
故选:C.
点评 本题考查了物质间的关系,明确物质的性质是解本题关键,根据其性质分析用途,掌握物质的性质,灵活运用知识解答,注意原电池工作原理,题目难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅胶疏松多孔,可用作催化剂的载体 | |
| B. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,甲、丙中气体密度分别为ρ1、ρ2,则ρ2>2ρ1 | |
| D. | 平衡时,SO2的转化率:α1<80%<α2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若x=y,且a+b=14,则pH>7 | B. | 若10x=y,且a+b=13,则pH=7 | ||
| C. | 若ax=by,且a+b=14,则pH=7 | D. | 若x=10y,且a+b=14,则pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 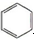 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$ 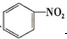 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH2═CH2+Br2→CH2Br-CH2Br;加成反应 | |
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;取代反应 | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应也属于取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com