
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述正确的是( )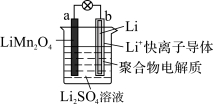
A.充电时,a为阴极
B.充电时,溶液中Li+从b向a迁移
C.电池放电时负极反应为Li-e-=Li+
D.利用该电池电解水,消耗锂14 g可生成气体33.6 L
科目:高中化学 来源:2015-2016学年四川省成都市高二下4月月考化学试卷(解析版) 题型:选择题
下列说法中错误的是:( )
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西重点中学协作体高二下学期期末化学试卷(解析版) 题型:实验题
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
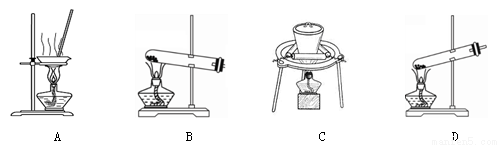
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论: 。 |
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察; | 现象: ; 结论:样品中含有NaHCO3。 |
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察。 | 现象: ; 结论: 。 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西重点中学协作体高二下学期期末化学试卷(解析版) 题型:选择题
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )
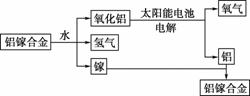
A.该过程中,能量的转化形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金与水反应的化学方程式为2Al+3H2O=Al2O3+3H2↑
D.总反应式为2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省资阳市高二下学期期末化学试卷(解析版) 题型:填空题
根据所学知识回答下列问题:
(1)有pH均为2的a盐酸、b醋酸两瓶溶液,与足量锌反应放出等体积H2所需时间的长短顺序是a____b(用“>”、“<”、“=”表示,下同);完全中和等物质的量的NaOH溶液需两种酸的体积大小顺序是a____b。
(2)已知:25℃时水的离子积为1×10-14。试回答:
①取pH=5的H2SO4溶液1 mL加水稀释至1000 mL后溶液中c(H+)∶c(SO42-)=____。
②将体积为Va、pH=13的NaOH溶液与体积为Vb、pH=1的H2SO4溶液混合:
若所得混合液为中性,则Va∶Vb=____;
若所得混合液pH=2,则Va∶Vb=____。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(天津卷精编版) 题型:选择题
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
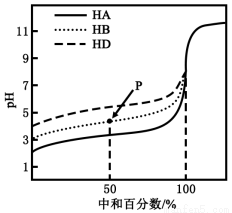
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(北京卷精编版) 题型:实验题
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
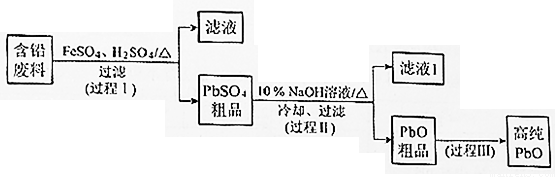
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42?=2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.______________。
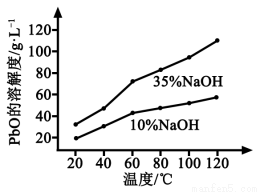
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq) NaHPbO2(aq),其溶解度曲线如图所示。
NaHPbO2(aq),其溶解度曲线如图所示。
①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是____._(选填序号)。
A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过滤Ⅲ的目的是提纯,综合上述溶解度曲线,简述过程Ⅲ的操作_______________________。
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(新课标3卷精编版) 题型:选择题
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(海南卷精编版) 题型:推断题
短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为______,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的____可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com