
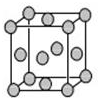
 已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1, I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
分析 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,T元素可形成自然界硬度最大的单质,则T为碳元素;W与T同周期,核外有一个未成对电子,原子序数大于碳,核外电子排布式为1s22s22p5,则W为氟元素;X原子的第四电离能剧增,所以X原子最外层有三个电子,则X为铝元素;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质,所以Y为S元素;Z的一种同位素的质量数为63,中子数为34,则Z的质子数为63-34=29,所以Z为铜元素.
(1)CS2与二氧化碳结构类似,直线形对称结构,结构式为S=C=S;W为氟元素,由于氟化氢分子之间存在着氢键,沸点较高,容易液化;
(2)发生反应:4Al+3 O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3,计算4molAl完全反应放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(3)Y为硫元素,原子核外电子排布式为1s22s22p63s23p4;同周期自左而右电负性增大,同主族自上而下电负性减小;
(4)Z为铜元素,根据均摊法计算晶胞中Cu原子数目,表示出晶胞质量,再结合m=ρV可以计算晶胞体积,进而计算晶胞棱长;
SO42-离子的中心原子S的价层电子对为:4+$\frac{6+2-2×4}{2}$=4,孤电子对数为0,杂化轨道数目为4;
在反应Cu+HCl+O2=CuCl+HO2中,O2是氧化剂,HO2是还原产物,HO2 (超氧酸)是一种弱酸,所以HO2在碱中不能稳定存在,1mol Cu参加反应被氧化成CuCl,有1mol电子发生转移.
解答 解:T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,T元素可形成自然界硬度最大的单质,则T为碳元素;W与T同周期,核外有一个未成对电子,原子序数大于碳,核外电子排布式为1s22s22p5,则W为氟元素;X原子的第四电离能剧增,所以X原子最外层有三个电子,则X为铝元素;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质,所以Y为S元素;Z的一种同位素的质量数为63,中子数为34,则Z的质子数为63-34=29,所以Z为铜元素.
(1)AY2化学式是CS2,其结构式为S=C=S,为直线型结构,分子中正负电荷重心重合,属于非极性分子,其分子中每个双键中含有1个σ键,所以CS2分子存在2个σ键.W为氟元素,由于氟化氢分子之间存在着氢键,所以氟化氢容易液化,
故答案为:非极性分子;2;氟化氢分子之间存在着氢键;
(2)13.5g的Al的物质的量为$\frac{13.5g}{27g/mol}$=0.5mol,4molAl在O2气体中完全燃烧后恢复至原状态放出的热量为419kJ×$\frac{4mol}{0.5mol}$=3352kJ,故热化学方程式为:4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol,
故答案为:4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol;
(3)Y为硫元素,原子核外电子排布式为1s22s22p63s23p4,最高能层符号为M,M能层具有s、p、d三个能级,s上有一个轨道,p上有三个轨道,d上有5个原子轨道,所以共有9个,硫原子的最外层电子数为6,
同周期自左而右电负性增大,同主族自上而下电负性减小,S、O、F元素的第一电离能由大到小顺序为 F>O>S,
故答案为:M;9; 6; F>O>S;
(4)Z为Cu元素,铜原子位于顶点和面心,每个晶胞中含有铜原子的数目为:8×$\frac{1}{8}$+6×$\frac{1}{4}$=4,晶胞中含有4个铜原子,则晶胞的质量为:$\frac{4×64}{{N}_{A}}$g,设该晶胞的边长为xcm,则该晶胞体积为:x3cm3,则:$\frac{4×64}{{N}_{A}}$g=x3cm3×9.00g/cm3,整理可得x=$\root{3}{4.72×1{0}^{-23}}$;
SO42-离子的中心原子S的价层电子对为:4+$\frac{6+2-2×4}{2}$=4,孤电子对数为0,故其空间结构为正四面体,杂化轨道数目为4,S原子杂化方式为:sp3,
A.O2中氧元素的化合价是0价,HO2中氧元素的平均化合价是-0.5价,化合价降低作氧化剂,故A正确;?
B.还原产物是HO2,故B错误;
C.HO2为超氧酸,应具有酸性,可与碱反应,故HO2在碱中不能稳定存在,故C错误;
D.1molCu参加反应生成+1价铜离子,有1mol电子发生转移,故D正确,
故答案为:$\root{3}{4.72×1{0}^{-23}}$;正四面体;sp3;AD.
点评 本题是对物质结构的考查,涉及核外电子排布、分子结构与性质、杂化方式、电负性、热化学方程式书写、氧化还原反应、晶胞计算等,是对物质结构主干知识的考查,熟练掌握基础知识并灵活运用,难度中等.


科目:高中化学 来源: 题型:选择题
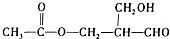 失去光学活性的是( )
失去光学活性的是( )| A. | H2 | B. | CH3COOH | C. | Cu/O2 | D. | Ag(NH3)2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 | |
| C. | 2015 年 10 月,中国科学家屠呦呦获得诺贝尔生理学或医学奖,以表彰她从青蒿中提取了青蒿素(C15H22O5),这种药品可以有效降低疟疾患者的死亡率 | |
| D. | 原子吸收光谱仪一般用于测定物质中的非金属元素,红外光谱仪可用于测定有机化合物中的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为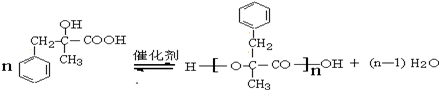 .
.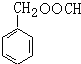 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

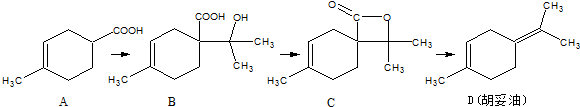
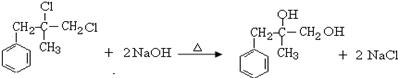
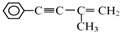 的反应条件是浓硫酸、加热.
的反应条件是浓硫酸、加热.
 或
或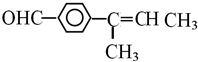 (任写一个)
(任写一个)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | |
| B. | 该反应中,SO2为还原剂 | |
| C. | 1 mol H2S中含有的共价键的数目为3 mol | |
| D. | 常温下,H2S的还原性强于S的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若电解熔融MgCl2产生1 mol Mg,理论上转移的电子数约为2×6.02×1023 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 室温下,pH均为3的盐酸和NH4Cl溶液中,水的电离程度相同 | |
| D. | 一定条件下反应2SO2+O2?2SO3达到平衡时,v正(O2)=2v逆(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液中CH3COOH的电离:CH3COOH=H ++CH3COO- | |
| B. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- | |
| C. | NaHCO3溶液中HCO3-的水解:HCO3-+H2 O?H3 O ++CO32- | |
| D. | 将FeCl3溶液滴入Na2CO3溶液中:2Fe3++3 CO32?+3 H2 O═2Fe(OH)3↓+3 CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com