
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④⑤ |
分析 ①NH4Cl与ZnCl2溶液水解显酸性;
②明矾能水解生成氢氧化铝胶体,能吸附水中的悬浮颗粒;
③草木灰显碱性与铵态氮肥显酸性;
④纯碱溶液水解显碱性;
⑤TiCl4是强酸弱碱盐,在加热时能水解.
解答 解:①NH4Cl与ZnCl2溶液水解显酸性,能与铁锈反应,所以可作焊接金属中的除锈剂,与盐的水解有关,故正确;
②明矾能水解生成氢氧化铝胶体,氢氧化铝胶体具有较大的表面积,能吸附水中的悬浮颗粒形成沉淀沉降,与盐的水解有关,故正确;
③草木灰显碱性与铵态氮肥显酸性,二者反应使肥效降低,所以草木灰与铵态氮肥不能混合施用,与盐的水解有关,故正确;
④纯碱溶液水解显碱性,能去除农药残留,故正确;
⑤TiCl4是强酸弱碱盐,在加热时能水解为Ti(OH)4,然后灼烧分解为TiO2,从而制得TiO2,故正确.
故选D.
点评 本题考查了盐的水解原理的应用,侧重于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
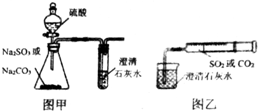 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
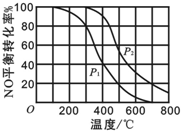 (1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.
(1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
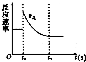 如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )
如图表示可逆反应A(g)+3B(g)?2C(g)△H<0达平衡后,t1时改变某一反应条件,反应速率随时间变化的情况,根据曲线判断下列说法中正确的是( )| A. | t1时降低了温度,平衡向正反应方向移动 | |
| B. | t1时增大了压强,平衡向正反应方向移动 | |
| C. | t1时可能使用了催化剂 | |
| D. | t1时增大了A的浓度,同时减小了C的浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
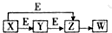 如图是某常见元素M的单质及其化合物间的转化关系图,其中X、Y、Z、W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( )
如图是某常见元素M的单质及其化合物间的转化关系图,其中X、Y、Z、W四种物质中均含有元素M,E是另一种单质,下列有关说法中不正确的是( )| A. | W可能是硫酸 | B. | Y不可能是Mg | C. | X可能是钠 | D. | Z可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物的研究在无机化学的发展中占有独特的地位.
硼及其化合物的研究在无机化学的发展中占有独特的地位. H++B(OH)4-
H++B(OH)4-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com