
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的结构式为________
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_________。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为_____,通入b气体的电极反应式_______.(质子交换膜只允许H+通过)

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
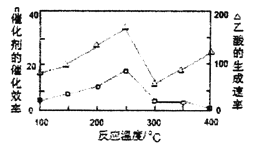
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在_________左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_________
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为________.
【答案】 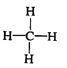 提供CH4分解所需的能量 负极 O2+4H++4e-=2H2O 250℃ 3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑ 1.6
提供CH4分解所需的能量 负极 O2+4H++4e-=2H2O 250℃ 3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑ 1.6
【解析】(1)甲烷为共价化合物,其结构为 ;正确答案:
;正确答案: 。
。
(2)甲烷高温分解生成氢气和碳,因此在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,可以为CH4分解提供所需的能量;正确答案:提供CH4分解所需的能量。
(3)由图可以知道,通入气体a的一端发生氧化反应,故应通入甲烷,该极为负极;通入b为氧气,获得电子,酸性条件下结合氢离子生成水,正极电极反应式为: O2+4H++4e-=2H2O ;正确答案:负极 ; O2+4H++4e-=2H2O 。
(4)①从图象可以知道:250℃时乙酸反应速率最大、催化活性高,故选择250℃;正确答案:250℃。
② CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,生成的盐为硝酸铝、硝酸铜,反应还有水生成,反应离子方程式为: 3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑;正确答案:3CuAlO2+16H++NO3-=3Cu2++3Al3++8H2O+NO↑。
(5)根据得失电子守恒,则:![]() ,计算得出
,计算得出![]() ;正确答案:1.6。
;正确答案:1.6。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
【题目】检验下列有机物的方法中正确的是 ( )
A.向氯仿中加入AgNO3溶液检验其含有氯元素
B.用KMnO4酸性溶液不能鉴别乙烯和乙炔
C.用FeCl3溶液鉴别苯和苯酚
D.用新制Cu(OH)2悬浊液鉴别乙醇、乙醛和乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol.则原混合气体中氢气的物质的量可能是( )
A.0.03mol
B.0.04mol
C.0.05mol
D.0.06mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 强酸性溶液中:K+、Cu2+、NO3-
B. 强碱性溶液中:Na+、NH4+、Cl-
C. 含1 mol·L-1 NH3·H2O的溶液中:K+、Al3+、SO42-
D. 含1 mol·L-1 Fe3+的溶液中:H+、Na+、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用组成物质的原子、离子或分子的一些特征性质,检验组成化学物质的元素,是研究物质组成的常用方法。下列叙述不正确的是( )
A.仅根据在火焰上燃烧产生的气味,不能确定毛线是“真羊毛”还是“人造羊毛”
B.用红外光谱仪确定物质中是否存在某些有机原子团
C.用元素分析仪确定物质中是否含有C H O N S Cl Br等元素
D.用原子吸收光谱确定物质中含有哪些金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用ClO2生产NaClO2并进行尾气处理的工艺如下:
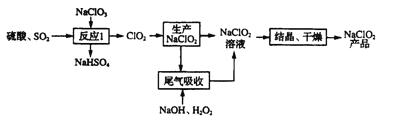
(1)写出“反应I”中生成ClO2的化学方程式:______
(2)“尾气吸收”是为了吸收未反应的ClO2,除减少污染外,还能______
(3)实验室用右图所示装置模拟“尾气吸收”过程,发现温度较低时吸收效果好,但该反应为放热反应。在不改变吸收液浓度和体积的条件下,欲使反应在0℃~5℃下进行,实验中可采取的措施有__________
(4)为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取1.000g上述产品,溶于水配成100.00ml,的溶液。
②取10.00mL待测液,加入过量的KI溶液,在酸性条件下发生如下反应:ClO2+4I-+4H+==2H2O+2I2+Cl-,杂质不与I-反应。
③以淀粉作指示剂,再加入0.2000mol/L Na2S2O3溶液,恰好完全反应时消耗Na2S2O3,溶液的体积为20.00mL。(已知:I2+2S2O32-=2I-+S4O62-)。计算该样品中NaClO2的纯度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为Pb+PbO2+4H++2SO ![]()
![]() 2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1 , 下列有关说法中不正确的是( )
2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1 , 下列有关说法中不正确的是( ) 
A.闭合S1时,左侧U形管为原电池,右侧U形管为电解池,F电极上生成氧气
B.若将两U形管中的溶液混合,混合液的质量分数仍为30%
C.若再单独闭合S2 , 电极
A.B的质量会逐渐增加,电极
B.F的质量会逐渐减小
C.若再单独闭合S2 ,
D.F电极上发生的反应与之前相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答问题
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
(1)酸性锌锰干电池的负极反应为
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zng.(结果保留到小数点后两位,F=96500C/mol)
(4)用回收分离出的锌皮制作七水合硫酸锌,需去除少量杂质铁,除杂步骤如下:①加入足量稀硫酸和溶液将锌皮溶解,此时锌离子浓度为0.1mol/L
②调节溶液的pH为到之间(结果保留到小数点后一位),过滤除去含铁元素的沉淀.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①H2(g)+ ![]() O2(g)═H2O(l)△H=﹣285.8kJmol﹣1
O2(g)═H2O(l)△H=﹣285.8kJmol﹣1
②H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJmol﹣1
O2(g)═H2O(g)△H=﹣241.8kJmol﹣1
③C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1
O2(g)═CO(g)△H=﹣110.5kJmol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
回答下列各问题:
(1)上述反应中属于放热反应的是 .
(2)H2的燃烧热为;C的燃烧热为 .
(3)燃烧10g H2生成液态水,放出的热量为 .
(4)CO燃烧的热化学方程式为;其燃烧热△H为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com