
下表中列出了25℃、101kPa时一些物质的燃烧热数据
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。则下列叙述正确的是( )
A.C≡C键能为796.0 kJ/mol
B.2CH4(g)+2O2(g)=2H2O(l) △H=﹣890.3 kJ/mol
C.H2(g)+1/2O2(g)=H2O(g) △H=﹣285.8 kJ/mol
D.2CH4(g)=C2H2(g)+3H2(g) △H=﹣376.4 kJ/mol
科目:高中化学 来源: 题型:
在2L的密闭容器中,充入1mol N2和 3mol H2,在一定条件下反应,2分钟后达到平衡状态,相同温度下,测得混合气体平衡时的压强比反应前混合气体的压强减小1/10,请问:
(1)平衡时混合气体中三种气体物质的量之比为n(N2):n(H2):n(NH3)= 。
(2)N2的转化率为 。
(3)2分钟内,NH3的平均反应速率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.汽车尾气中有NOx,主要是汽油不充分燃烧引起的
B.发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品
C.BaSO4难溶于水,医疗上可用做钡餐
D.为改善食物的色、香、味并防止变质,可在其中加入适量食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+ B.Y3+、Z2- C. X+、Y3+ D.X+、Z2-
查看答案和解析>>
科目:高中化学 来源: 题型:
将四个分别盛有足量硫酸铜溶液、氯化铜溶液、氢氧化钾溶液、氯化钠溶液的电解槽串联,用惰性电极电解一段时间后四个电解槽两极共产生气体在同温同压下的体积之比为( )
A.1:1:2:2 B. 1:2:3:4 C. 1:2:2:1 D.2:2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ. 铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。
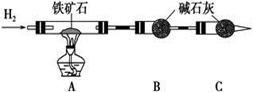
(1) 按上图组装仪器,并检查装置的气密性;
(2) 将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3) 从左端导气管口处不断地缓缓通入H2,____________________________,再点燃A处酒精灯;
(4) 充分反应后,撤掉酒精灯,再持续通入氢气至硬质玻璃管完全冷却;
(5) 测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ. 铁矿石中含铁量的测定,流程如下。

(1) 步骤④中煮沸的作用是___________________________________________。
(2) 步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、________。
(3) 下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c. 滴定前没有气泡,滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
d. 滴定过程中,眼睛注视滴定管中液面变化
e. 滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(4) 滴定过程中消耗了0.500 0 mol·L-1 KI溶液20.00 mL。
Ⅲ. 由Ⅰ、Ⅱ可以推算出该铁矿石中如只有一种铁的氧化物,则其化学式为_____ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能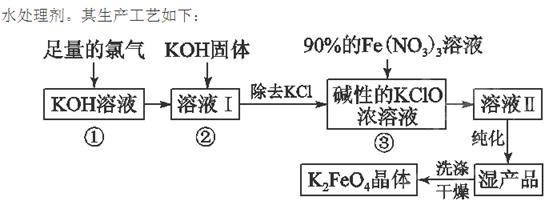 (1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO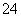 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应(表内物质均为反应物)刚开始时,放出H2速率最大的是
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.1 mol | 18.4 mol/L H2SO4 | 10 mL | 60 ℃ |
| B | Mg | 0.1 mol | 3 mol/L HCl | 10 mL | 30 ℃ |
| C | Fe | 0.1 mol | 3 mol/L H2SO4 | 10 mL | 60 ℃ |
| D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10 mL | 60 ℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com