
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
![]()
则x= 。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) ![]() HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时v(HCOOCH3)= 。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) = 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正) v(逆)(填“﹥”“﹤”“﹦”),原因是 。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“﹥”“﹤”“﹦”),判断的理由是 。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
NO+CO![]() N2+ CO2(有CO) 2NO
N2+ CO2(有CO) 2NO![]() N2+ O2(无CO)
N2+ O2(无CO)
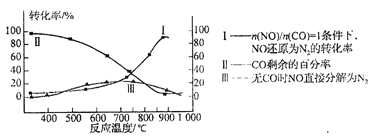
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 。
②在n(NO)/ n(CO)=1的条件下,应控制最佳温度在 左右。
【答案】
(1)1076
(2)①Ⅱ中使用催化剂 ②0.10 mol·L-1·min-1 ③2 L·mol-1 ﹤ 浓度商Qc=1.5/(0.5·1)=3﹥2=K 反应向逆方向进行,故v(正) ﹤v(逆) ④﹥此反应为放热反应,降温,平衡向正向进行(或反应Ⅰ达平衡时所需的时间比反应Ⅲ达平衡时所需的时间短,反应速率快,故T1温度更高)
(3)①此反应为放热反应,升高温度反应更有利于向逆反应方向进行 ②870(或850~900之间都可以)
【解析】
试题分析:
(1)反应物断键共吸收热量(x + 436×2),生成物成键共放出热量(413×3+343+465)。则有ΔH=(x + 436×2)-(413×3+343+465)=-99kJ·mol-1,计算可得x=1076;
(2)①该反应为气体系数减小的放热反应。Ⅱ和Ⅰ相比,先达到化学平衡,但平衡时体系的总压强没有改变,说明平衡未发生移动,因此改变的条件为加入正催化剂。
②相同的温度和体积之下,压强之比等于物质的量之比,可得反应后各物质的总物质的量为3mol,根据三段式或差量法可得生成的HCOOCH3为1mol,则可得v(HCOOCH3)=0.10 mol·L-1·min-1
③平衡常数![]() , 浓度商Qc=1.5/(0.5·1)=3﹥2=K 反应向逆方向进行,故v(正) ﹤v(逆)
, 浓度商Qc=1.5/(0.5·1)=3﹥2=K 反应向逆方向进行,故v(正) ﹤v(逆)
④反应Ⅰ达平衡时所需的时间比反应Ⅲ达平衡时所需的时间短,反应速率快,故T1温度更高
(3)①此反应为放热反应,升高温度反应更有利于向逆反应方向进行
②由图像可知850~900之间NO转化率较高。


科目:高中化学 来源: 题型:
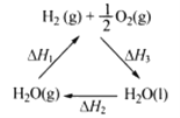
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的综合利用对于改善大气质量和能源充分利用有重要的意义。
(1)下列说法正确的是 (填序号)。
a.煤是由有机物和少量无机物组成的复杂混合物
b.煤在燃烧过程中会生成一氧化碳、二氧化碳、氮氧化物、烟尘等有害物质
c.可利用生石灰、熟石灰、石灰石等固硫剂使煤在燃烧过程中生成稳定的硫酸盐
d.煤的干馏属于化学变化,煤的气化和液化都属于物理变化
(2)煤的气化过程中产生的有害气体H2S用氨水吸收生成正盐的离子方程式是
。
(3)燃煤烟气的一种脱硫方案-火碱-石灰-石膏法流程图1如下:
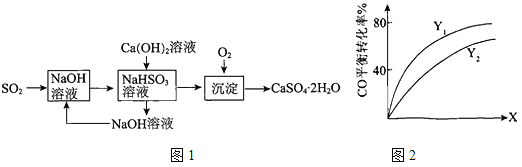
①常温下,用NaOH溶液吸收SO2得到pH=6的NaHSO3溶液,该溶液中离子浓度的大小顺序是
。
②氢氧化钙与NaHSO3反应的化学方程式是 。
(4)煤的间接液化法合成二甲醚的三步反应如下:
Ⅰ.2H2(g)+CO(g) ![]() CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1
Ⅱ.2CH3OH(g) ![]() CH3OCH3(g)+ H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H=-23.5 kJ·mol-1
Ⅲ.CO(g) + H2O(g) ![]() CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1
① 总反应热化学方程式:3H2(g)+ 3CO(g) ![]() CH3OCH3(g)+ CO2(g) △H=
CH3OCH3(g)+ CO2(g) △H=
② Y(Y1、Y2),X可分别代表压强或温度。如图2表示Y一定时,总反应中CO的平衡转化率随X的变化关系。判断Y1、Y2的大小关系,并简述理由:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化锶晶体在工业上常用作铝的缓蚀剂。工业上一般用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体(SrCl2·6H2O)的过程为:

已知:Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ. 有关氢氧化物开始沉淀和完全沉淀的pH如下表:
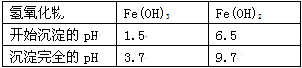
(1)操作①在实际工业生产中常常把碳酸锶粉碎并加以搅拌,其目的是 。碳酸锶与盐酸反应的化学方程式为 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为__________。能否用新制氯水代替双氧水 (填“能”或“否”)。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至 ;宜用的试剂为 。
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是 。
(6)步骤⑥中,洗涤氯化锶晶体最好选用 。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30 mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
① 能否各取少许固体用舌头品尝?_____。(选填“能”或“不能”)
② 用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有___性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置如图所示。
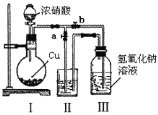
已知:2NO2+2NaOH=NaNO2+NaNO3+H2O。
① 写出装置I中发生反应的化学方程式___________________________________。
② 水_______(选填“能"或“不能”)作为装置II中的试剂,理由是_________________。
③ 装置III中反应完全后,接下来的操作是_________________________________。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_______(选填“增多”、“减少"或“不变”),原因可能是______________(用化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
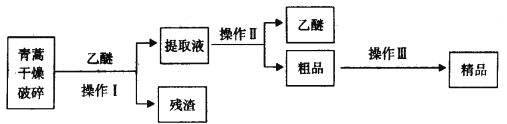
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、_________,操作Ⅱ的名称是_______________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
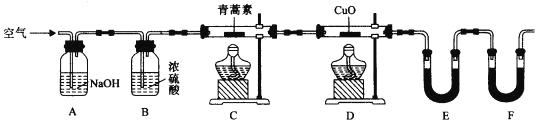
①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:
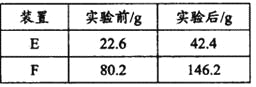
则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:
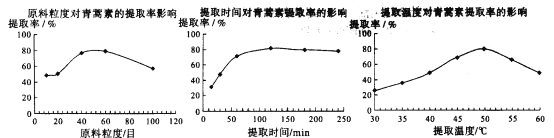
由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室制备、收集干燥的 SO2,所需仪器如下图。
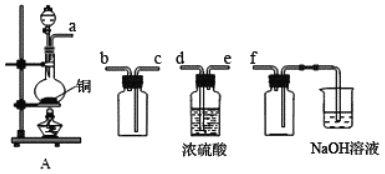
(1)装置A产生SO2,按气流方向连接各仪器接口,顺序为 a→___→___→___→___→f。
(2)验证产生的气体是 SO2的方法及实验现象是_________________________________。
(3)若在1 L 0.3 mol/L的 NaOH溶液中,通入4.48 L SO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+ c(H+)= c(HSO3-)+2 c(SO32-)+ c(OH-),请再写出两个等量关系: ________________。
II.SO2 气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:
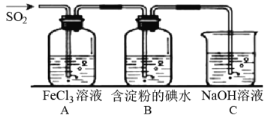
(4)若要从FeCl3溶液中提取晶体,必须进行的实验操作步骤中没有用到的玻璃仪器有_________。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(5)装置 A 中的现象是_________________,写出 B 中发生反应的离子方程式:___________________。
(6)在上述装置中通入过量的 SO2,为了验证A中SO2与 Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入 KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置是用燃烧法确定有机物分子式常用的装置。
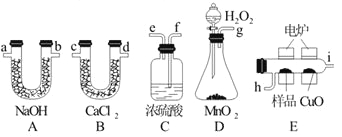
已知产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是g→f→e→h→i→c→d→a→b→f。
(1)C装置中浓硫酸的作用是________________________。
(2)D装置中MnO2的作用是_______________________。
(3)燃烧管中CuO的作用是_____________________。
(4)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管 质量增加1.76 g,B管质量增加1.08 g,则该样品的化学式为_________。
(5)若该物质的核磁共振氢谱如下图所示,
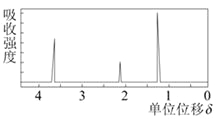
则其结构简式为___________________,该有机物的同分异构体结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Q、R、X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大,其中Q原子外层电子数是内层电子数的两倍;化合物R2Z的晶体为离子晶体,Z原子核外的M层中有两对成对电子;X元素最外层电子数与最内层电子数相同;Y单质的晶体类型在同周期的单质中没有相同的;W元素所在族有三列,只有两个未成对的电子。请根据以上信息,回答下列问题:(答题时,Q、R、X、Y、Z、W用所对应的元素符号表示)
(1)W的外围电子(价电子)排布式是 。
(2)Q、R、X、Y的第一电离能由小到大的顺序为_ 。(用元素符号表示)
(3)QZ2分子的空间构型为 形。
(4)R的氯化物的熔点比Y的氯化物的熔点_ _(填高或低),理由是_ _ 。
(5)据报道,只含Q、X、W三种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构如图,试写出该晶体的化学式_ 。晶体中每个X原子周围距离最近的W原子有__ _个。
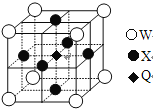
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com