
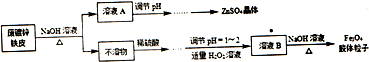
分析 废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子.
(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,为缩短用NaOH溶液处理废镀锌铁皮的时间,可以加热、将固体粉碎;
(2)H2O2具有氧化性,能将亚铁离子氧化;Fe3O4可以看做FeO•Fe2O3,故溶液B中n(Fe2+):n(Fe3+)=1:2,
(3)持续通入N2,防止Fe2+被氧化;
(4)向溶液A中通入CO2气体,得到Zn(OH)2沉淀,然后过滤、洗涤沉淀,用适量的稀硫酸将沉淀完全溶解,将溶液加热浓缩、冷却、洗涤、干燥即可得到ZnSO4晶体.
解答 解:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子.
(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,为缩短用NaOH溶液处理废镀锌铁皮的时间,可以加热、将固体粉碎;
故答案为:除去表面的油污;加热、将固体粉碎;
(2)H2O2具有氧化性,能将亚铁离子氧化;Fe3O4可以看做FeO•Fe2O3,故溶液B中n(Fe2+):n(Fe3+)=1:2,
故答案为:氧化亚铁离子、1:2;
(3)持续通入N2,防止Fe2+被氧化,故答案为:防止Fe2+被氧化;
(4)向溶液A中通入CO2气体,得到Zn(OH)2沉淀,然后过滤、洗涤沉淀,用适量的稀硫酸将沉淀完全溶解,将溶液加热浓缩、冷却、洗涤、干燥即可得到ZnSO4晶体;
故答案为:过滤;用适量的稀硫酸将沉淀完全溶解.
点评 本题以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查实验基本操作和技能,涉及标准溶液的配制、对信息的利用、实验条件的控制等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 28g N2、N2O、N2O4的混合气体含有氮原子数为2NA | |
| B. | 质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA | |
| C. | 0.5 mol•L-1的乙酸溶液中,乙酸分子的数目小于0.5NA | |
| D. | 78g苯分子中含有碳碳双键数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若生成物C和D分别为盐和水,则该反应一定是中和反应 | |
| B. | 若A和C是单质,B和D是化合物,则该反应一定是置换反应 | |
| C. | 若A是可溶性碱,B是可溶性盐,则C和D不可能是两种沉淀 | |
| D. | 若A是可溶性碱,B是可溶性盐,则C和D一定是另一种碱和另一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
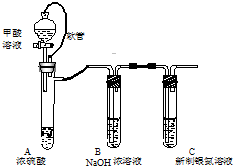 银氨溶液可用于检测CO气体,实验室研究的装置如图:
银氨溶液可用于检测CO气体,实验室研究的装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1131.2 | B. | -647.6 | C. | -507.8 | D. | -323.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
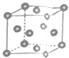
| A. | 只有金属钋原子采用这种堆积方式 | B. | 这种堆积方式中,配位数为8 | ||
| C. | 这是金属晶体的一种最密堆积方式 | D. | 这种堆积方式的空间利用率较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +319.68kJ•mol-1 | B. | +259.7kJ•mol-1 | C. | -319.68kJ•mol-1 | D. | -259.7kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com