
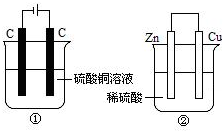
 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积 ①=② |
| B、①中阴极质量增加,②中正极质量减小 |
| C、溶液的pH变化:①减小,②增大 |
| D、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |


科目:高中化学 来源: 题型:
| A、c(Na+)=c(H2SO3)+c(HSO3-)+c (H+) |
| B、c(SO32-)+c(OH-)=c(H+)+c(H2SO3) |
| C、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | A(g) | B(g) | C(g) |
| 物质的量/mol | 1.2 | 0.6 | 0.6 |
| A、反应前20 s内的平均反应速率为v(A)=0.6 mol?L-1?s-1 |
| B、20 s时,正反应速率大于逆反应速率 |
| C、达到平衡时,A(g)的转化率为100% |
| D、若升高温度平衡常数变为2,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(盐酸)<n(稀硝酸)<n(烧碱) |
| B、n(烧碱)<n(盐酸)<n(稀硝酸) |
| C、n(烧碱)<n(稀硝酸)<n(盐酸) |
| D、n(稀硝酸)<n(烧碱)<n(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40% | B、20% |
| C、80% | D、15% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com