
| A. | 通过红外光谱分析可以区分乙醇与乙酸乙酯 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| C. | 淀粉可用于制备葡萄糖、酿制食醋,还可作药片的赋形剂 | |
| D. | 利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
分析 A.根据乙醇与乙酸乙酯中含有的官能团以及红外光谱主要用于分析有机物中的官能团类分析;
B.花生油是植物油,是不饱和酯类;
C.淀粉水解生成葡萄糖,葡萄糖分解生成乙醇,乙醇能被氧化为乙酸;
D.利用太阳能和催化剂分解水没有污染.
解答 解:A.乙醇中含有羟基,乙酸乙酯中含有酯基,官能团不同,所以通过红外光谱分析可以区分乙醇与乙酸乙酯,故A正确;
B.花生油是不饱和酯类,牛油是饱和酯类,故B错误;
C.淀粉水解生成葡萄糖,葡萄糖分解生成乙醇,乙醇能被氧化为乙酸,另外淀粉可作药片的赋形剂,故C正确;
D.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能,不消耗能源,也不产生污染,是一种绿色化学方法,故D正确.
故选B.
点评 本题考查较为综合,涉及有机物的鉴别、油脂的结构、糖类的性质以及绿色化学等知识,题目难度不大,注意对相关知识的积累,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
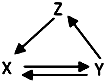 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | SiO2 | H2SiO3 | Na2SiO3 |
| ② | CH3CH2OH | CH3CHO | CH2=CH2 |
| ③ | AlCl3 | Al(OH)3 | Al2O3 |
| ④ | NO | NO2 | HNO3 |
| ⑤ | FeCl2 | Fe | FeCl3 |
| A. | ③④⑤ | B. | ②③④ | C. | ④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Ba2+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| B. | 100mL 18.4mol•L-1 的浓硫酸与足量的铜加热反应后,生成SO2 分子数为0.92NA | |
| C. | 将CO2 通过Na2O2 ,当固体质量增加a g时,反应中转移的电子数为a$\frac{{N}_{A}}{28}$ | |
| D. | 标准状况下,11.2L正丁烷所含公用电子对数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有HNO3和H2SO4,将其倒入NaOH溶液中,静止,分液 | |
| D. | 乙烯中混有SO2,将其通入酸性高锰酸钾溶液中洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com