
【题目】【化学-有机化学基础】聚合物F的合成路线图如下:
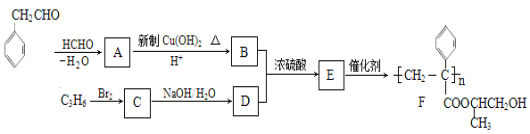
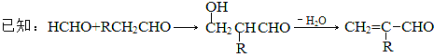
请据此回答:
(1) A中含氧官能团名称是_______,C的系统命名为_________。
(2) 检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为___________(同一个碳原子上连两个碳碳双键的除外)。
(4)G物质与![]() 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比![]() 大14的,则符合下列条件的G的同分异构体有__________种。
大14的,则符合下列条件的G的同分异构体有__________种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色 ③ 能与溴水发生加成反应
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 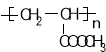 的合成路线 。
的合成路线 。
【答案】(1)醛基(1分);1,2-二溴丙烷(2分)
(2)NaHCO3溶液(或Na2CO3)、溴水(或Br2的CCl4溶液)(2分);加聚反应(1分)
(3)CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr(2分);CH3C≡CH(2分)
(4)9(2分)(5)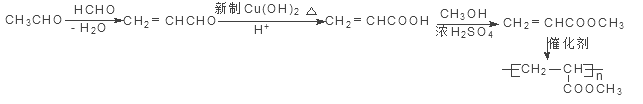
【解析】
试题分析:(1)根据已知信息,苯乙醛发生反应生成A,A为![]() ,其所含氧官能团为醛基;醛基变为羧基,据F的结构简式可知,C3H6为丙烯,其与溴发出加成反应生成的C为1,2-二溴丙烷。
,其所含氧官能团为醛基;醛基变为羧基,据F的结构简式可知,C3H6为丙烯,其与溴发出加成反应生成的C为1,2-二溴丙烷。
(2)B中含有的官能团为羧基和碳碳双键,用碳酸氢钠溶液检验羧基,用溴水检验碳碳双键,E为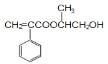 ,E通过加聚反应生成F。
,E通过加聚反应生成F。
(3)C为1,2-二溴丙烷,能水解生成D,D为1,2-二羟基丙醇,反应的化学方程式为CH3CHBrCH2Br+2NaOH →CH3CH(OH)CH2OH+2NaBr;C与氢氧化钠的水溶液发生消去反应生成丙炔,结构简式为CH3C≡CH。
(4)G物质与![]() 互为同系物,含有醛基 和苯环,G物质的相对分子质量比
互为同系物,含有醛基 和苯环,G物质的相对分子质量比![]() 大14,即多一个-CH2-部分,符合条件的G的同分异构体有C6H5-和-CH2CH2CHO或-CH(CH3)CHO两种,HO-C6H4-和-CH=CHCH3或-CH2CH=CH2,苯环位置有邻间对三种,有6种,含有C6H5-和-CH(CH3)CH=CH2,共9种。
大14,即多一个-CH2-部分,符合条件的G的同分异构体有C6H5-和-CH2CH2CHO或-CH(CH3)CHO两种,HO-C6H4-和-CH=CHCH3或-CH2CH=CH2,苯环位置有邻间对三种,有6种,含有C6H5-和-CH(CH3)CH=CH2,共9种。
(5)据已知反应可知,甲醛与乙醛发生羟醛缩合反应后失水生成CH2=CHCHO,然后用弱氧化剂新制氢氧化铜将醛基氧化为羧基,再与甲醇发生酯化反应生成CH2=CHCOOCH3,发生加聚反应可得![]() ,具体流程为:
,具体流程为:
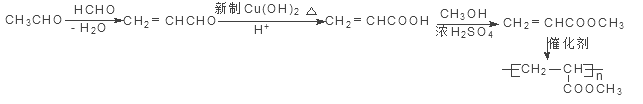 。
。


科目:高中化学 来源: 题型:
【题目】用氟硼酸(HBF4,属于强酸)代替硫酸作铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,其中Pb(BF4)2为可溶于水的强电解质,用该铅蓄电池分别电解AgNO3溶液和Na2SO3溶液,装置如下图,a、b、c、d电极材料均为石墨,通电时a电极质量增加。
2Pb(BF4)2+2H2O,其中Pb(BF4)2为可溶于水的强电解质,用该铅蓄电池分别电解AgNO3溶液和Na2SO3溶液,装置如下图,a、b、c、d电极材料均为石墨,通电时a电极质量增加。
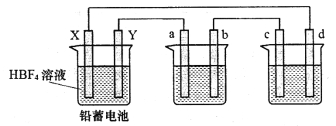
回答下列问题:
(1)d电极为该装置的___________极,工作时,该池内d电极上无气体产生,写出该池内电解反应的离子方程式:_____________________。
(2)该铅蓄电池放电时X极附近pH_____________ (填“增大”、“减小”或“不变”),正极的电极反应式为______________________。
(3)铅蓄电池充电时,Y电极与电源的_________(填“正极”或“负极”)相连。
(4)另取一常规铅蓄电池(浓硫酸作电解质溶液)与该铅蓄电池同时放电,当电路中均通过1 mol电子时,分别取下Y电极称重,两电极质量相差__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.化学只研究自然界中存在的物质
B.化学的特征是认识分子和制造分子
C.通过化学方法可以制造出使人长生不老的“仙丹”
D.化学的研究层面越来越广,原子核的变化也已成为化学研究的范畴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25 ℃时0.1 mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
C.NaHCO3溶液中溶质的电离方程式为NaHCO3===Na++H++CO![]()
D.室温下,对于0.10 mol·L-1的氨水,加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水提取溴的过程中,吸收塔内溴蒸气和吸收剂SO2发生的化学反应为:Br2+SO2+2H2O=2HBr+H2SO4 , 下列说法正确的是( )
A.SO2在反应中被还原
B.Br2在反应中失去电子
C.Br2在反应中表现氧化性
D.1mol氧化剂在反应中得到1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是
A.FeSO4(Fe) B.SnCl2(HCl) C.FeCl3(HCl) D.NaAlO2(NaOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A分子的球棍模型和B分子的比例模型,回答下列问题:

(1)A和B的关系是 。
(2)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式 。
(3)写出B分子和金属钠反应的化学方程式 。
(4)B在加热条件下能够和HBr发生反应生成溴乙烷,该反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是研究化学反应的有效方法。
Ⅰ.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得。无水草酸100℃可以升华。某学习小组用下图装置模拟工业制取收集ClO2 。
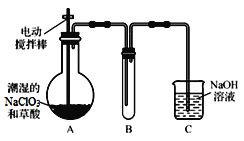
(1)实验时装置A需在60℃~100℃进行的原因是 ,控制所需温度的方法是 。
(2)电动搅拌棒的作用是 。装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为 。
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2 ,写出反应的离子方程式 。
Ⅱ. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是_______________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:

分析上图能够得出的实验结论是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com