
| 实验 | 操作 | |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用稀硫酸清洗过的铂丝分别蘸取溶液,在酒精灯外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠与水反应剧烈,放入装满水的烧杯,溶液溅易发生危险;
B.碳酸氢钠和碳酸钠都能够与氢氧化钙反应生成碳酸钙沉淀;
C.棉花燃烧说明过氧化钠与二氧化碳的反应是放热反应;
D.硫酸盐沸点较高,清洗铂丝应该用稀盐酸,不能用稀硫酸.
解答 解:A.用镊子从煤油中取出金属钠,切下绿豆大小的钠,用滤纸擦净后小心放入装少量水的烧杯中,观察现象,故A错误;
B.检验NaHCO3与Na2CO3溶液,若滴加澄清石灰水,二者都能够与氢氧化钙反应生成碳酸钙沉淀,应该用氯化钡或氯化钙溶液检验,故B错误;
C.Na2O2用棉花包裹,放入充满CO2的集气瓶中,过氧化钠与二氧化碳反应生成碳酸钠和氧气,棉花燃烧说明该反应放出大量热,可证明该反应是放热反应,故C正确;
D.由于盐酸盐沸点较高,且盐酸易挥发,而硫酸盐沸点较高,则焰色反应中应该用稀盐酸清洗铂丝,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及钠的性质、物质检验方法、过氧化钠性质、焰色反应操作方法等知识,明确化学实验基本操作方法为解答关键,注意熟练掌握常见元素及其化合物性质.


科目:高中化学 来源: 题型:选择题
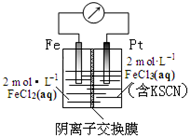
| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e?=Fe | |
| D. | 若转移1mol e-,交换膜左侧溶液中则减少1 molCl- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
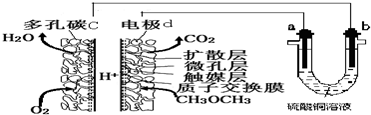
| A. | 多孔碳c能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 燃料电池工作时,电极d上发生的反应为:CH3OCH3+12e-+3H2O═2CO2+12H+ | |
| C. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇CH3OH)直接燃料电池能量密度的1.4倍 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 工业粉尘中含有Pb、Cd、Cr、V、As等金属元素,过量摄入均对人体有害 | |
| C. | 用工业明胶制作用药胶囊,会导致过量Cr元素摄入人体而提高致癌风险 | |
| D. | 分光光度计通过测定溶液颜色分析反应物(或生成物)浓度变化,从而确定化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
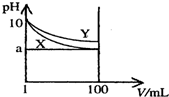 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | Y碱溶液稀释过程中溶液中c(H+)减小 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性弱 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY | |
| D. | 若8<a<10,则X、Y都是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20倍 | B. | 100倍 | C. | 200倍 | D. | 500倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com