
A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,则该反应的离子方程式是 _____________________________;将Y与等物的量的SO2充分混合后通入品红溶液,未见其褪色,原因是__________________________________________(请用化学方程式解释说明)。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶
液为某浓酸,则反应所得的氧化产物的化学式为 。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,而且A可溶于X溶液中:
① A元素的元素符号为 ,则A与B的反应中氧化剂与还原剂的物质的量之比是 。
② 若含a mol X的溶液溶解了一定量A后,此时溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量为 mol(用含a代数式表示);为保证A与B充分反应后最终所得的溶液中同时含有上述两种金属阳离子,则此时B与A的质量比应满足的取值范围是 。
(1)MnO2+4Cl-+2H+ Mn2++Cl2↑+2H2O (2分) SO2 + Cl2 + 2H2O = H2SO4
+ 2HCl (2分)
Mn2++Cl2↑+2H2O (2分) SO2 + Cl2 + 2H2O = H2SO4
+ 2HCl (2分)
(2)CO2 (1分)
(3)①Fe(1分) 1:1 (1分) ②0.4a (1分 ) 3/1 < m(B)/m(A) < 9/2 (2分)
【解析】
试题分析:(1)中学化学中黄绿色气体就是指氯气。MnO2+4Cl-+2H+ Mn2++Cl2↑+2H2O;将氯气与等物的量的SO2充分混合后通入品红溶液溶液不变色,是因为二者反应生成硫酸和盐酸,失去漂白性。
Mn2++Cl2↑+2H2O;将氯气与等物的量的SO2充分混合后通入品红溶液溶液不变色,是因为二者反应生成硫酸和盐酸,失去漂白性。
SO2 + Cl2 + 2H2O = H2SO4 + 2HCl (2分)
(2)原子核外最外层电子数是次外层电子数的2倍,表明A是C,A、B的物质的量之比为1:4,表明B一定是浓硝酸。因此反应所得的氧化产物的化学式为:CO2 (1分)
(3)①金属单质常温下发生“钝化”的只有铁和铝,但是只有铁能溶于三价铁离子的溶液,因此A元素的元素符号为:Fe;Fe+4HNO3=Fe(NO3)3+NO↑+2H2O ;A与B的反应中氧化剂与还原剂的物质的量之比是1:1
② Fe + 2Fe3+ = 3Fe2+
开始: amol 0mol
转化: bmol 1.5bmol
最终: (a-b)mol 1.5bmol
依题意有:(a-b)mol=1.5bmol
解之得:b=0.4a
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
56 4×63 3×56 8×63
所以B与A的质量比应满足的取值范围是:3/1 < m(B)/m(A) < 9/2 (2分)
考点:氧化还原反应的有关知识。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
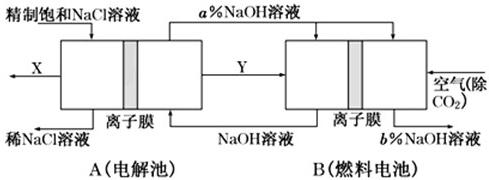 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )
氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )| A、X为H2,Y为Cl2 | B、A池为电解池,且m<n | C、B池为燃料电池,且b<a | D、该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.(CO)a(CO2)x(H2O)y、(H2)a(CO2)x(H2O)y、(CO)b(H2)a-b(CO2)y(H2O)x
B.(CO)a(H2O)x(H2)b(CO2)x(H2O)y、(CO)a(H2)b(CO2)y(H2O)x
C.CaHb(CO2)x(H2O)y、CbHa(CO2)y、(H2O)x
D.Ca+1Hb-4(CO2)x(H2O)y、Ca-1Hb+4(CO2)y(H2O)x
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省高三上学期10月份月考化学试卷 题型:选择题
定温度、压强和有铁触媒的条件下,在密闭容器中充入N2、H2和NH3 。若起始时n(N2)=x mol、n(H2)=y mol、n(NH3)=z mol (x、y、z均不为0 ),平衡时,n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是( )
A.x : y =1 : 3
B.N2、H2的转化率不相等
C.平衡时,H2与NH3的生成速率之比为3 : 2
D.x的取值范围为0<x<0.14
查看答案和解析>>
科目:高中化学 来源: 题型:
.定温度、压强和有铁触媒的条件下,在密闭容器中充入N2、H2和NH3 。若起始时n(N2)=x mol、n(H2)=y mol、n(NH3)=z mol (x、y、z均不为0 ),平衡时,n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是( )
A.x : y =1 : 3
B.N2、H2的转化率不相等
C.平衡时,H2与NH3的生成速率之比为3 : 2
D.x的取值范围为0<x<0.14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com