
һ���¶��£���2mol A��2mol B���������������Ϊ2 L��ij���ݵ��ܱ������У��������·�Ӧ��3A(g)+B(g) x
C(g)��2D(g)��
x
C(g)��2D(g)��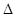 H ��0��2min ĩ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��������0.8 mol D�������C��Ũ��Ϊ0.4
mol/L������д���пհף�
H ��0��2min ĩ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��������0.8 mol D�������C��Ũ��Ϊ0.4
mol/L������д���пհף�
��1��X��ֵ���� ��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������¶�ʱKֵ��
�����������С���������䡱��
��3��A���ʵ�ת����Ϊ ��
��4����ά���¶Ȳ��䣬��ԭƽ��������������ٳ���3mol C��3mol D����ʹ�ﵽ�µ�ƽ��ʱ�������ʵ����ʵ���������ԭƽ����ͬ��������Ӧ�ٳ���B�����ʵ���Ϊ mol������ƽ��ʱ��A�����ʵ���Ϊn��A��= mol��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ڹ�ũҵ������Ӧ�ù㷺����ѹǿΪ30MPaʱ���ϳɰ�ƽ����������NH3������������£�
���ڹ�ũҵ������Ӧ�ù㷺����ѹǿΪ30MPaʱ���ϳɰ�ƽ����������NH3������������£�| �¶�/�� | 200 | 300 | 400 | 500 | 600 |
| ������/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ӱ�ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��һ���¶��£���2mol A��2mol B�����������������Ϊ
2 L��ij�ܱ������У��ݻ����䣩���������·�Ӧ��3A(g)+B(g) x
C(g)��2D(g)
x
C(g)��2D(g)  H ��0�� 2minĩ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��������0.8 mol D�������C��Ũ��Ϊ0.4 mol/L������д���пհף�
H ��0�� 2minĩ��Ӧ�ﵽƽ��״̬���¶Ȳ��䣩��������0.8 mol D�������C��Ũ��Ϊ0.4 mol/L������д���пհף�
��1��X��ֵ���� ��
��2������÷�Ӧ�Ļ�ѧƽ�ⳣ��K= �������¶�ʱKֵ
�� ��ѡ���������С���������䡱����
��3��A�����ʵ�ת����Ϊ ��
��4����ά���¶Ȳ��䣬��ԭƽ��������������ٳ���3mol C��3mol D����ʹ�ﵽ�µ�ƽ��ʱ�������ʵ����ʵ���������ԭƽ����ͬ��������Ӧ�ٳ���B�����ʵ���Ϊ mol������ƽ��ʱ��A�����ʵ���Ϊn��A��= mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com