
| A、提纯NaCl和KNO3的混合物中的KNO3:加热蒸发、冷却结晶,过滤 |
| B、除去CO2中混有的少量CO:混合气体依次通过NaOH溶液和浓硫酸 |
| C、除去盐酸溶液中混有的少量CaCl2:加入过量CaCO3粉末,过滤 |
| D、将自来水制成蒸馏水:蒸馏 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
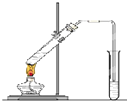 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
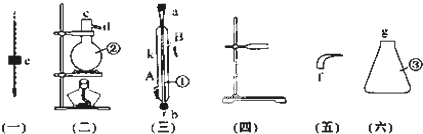
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| B、甲酸与乙二酸互为同系物 |
| C、用浓Na2SO4、CuSO4溶液或浓硝酸溶液使蛋清液发生盐析,进而分离、提纯蛋白质 |
D、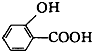 (水杨酸)与足量的NaHCO3溶液反应可生成 (水杨酸)与足量的NaHCO3溶液反应可生成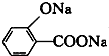 、CO2和H2O 、CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
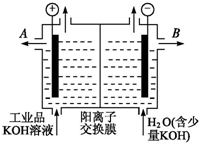 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com