
 Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是
Ca2+ +2OH一中,能使c(Ca2+)减小,而使c(OH一)增大的是| A.加入少量MgCl2固体 | B.加入少量Na2CO3固体 |
| C.加入少量KCl固体 | D.加入少量Ba(OH)2固体 |
 Ca2+ +2OH一中,加入少量MgCl2固体,能使c(Ca2+)增大,而使c(OH一)减小,故A错误;加入少量Na2CO3固体,能使c(Ca2+)减小,而使c(OH一)增大,故B正确;加入少量KCl固体 ,溶液中c(Ca2+),c(OH一)不变,平衡不移动,故C错误;加入少量Ba(OH)2固体,c(Ca2+)减小,虽然平衡向左移动,但是根据勒夏特勒原理可以知道,c(OH一)比原来还是大了,所以D也正确,故本题的答案选择BD。
Ca2+ +2OH一中,加入少量MgCl2固体,能使c(Ca2+)增大,而使c(OH一)减小,故A错误;加入少量Na2CO3固体,能使c(Ca2+)减小,而使c(OH一)增大,故B正确;加入少量KCl固体 ,溶液中c(Ca2+),c(OH一)不变,平衡不移动,故C错误;加入少量Ba(OH)2固体,c(Ca2+)减小,虽然平衡向左移动,但是根据勒夏特勒原理可以知道,c(OH一)比原来还是大了,所以D也正确,故本题的答案选择BD。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题

| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____:
Fe+2NaCl,该电池放电时,正极反应式为 ________________ _____: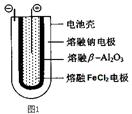
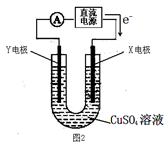
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.往溶液中滴入稀硫酸 | B.往溶液中加入NH4Cl晶体 |
| C.把溶液加热至沸腾 | D.往溶液中加入NaOH固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HCO3-+OH-,下列说法正确的是( )
HCO3-+OH-,下列说法正确的是( ) | A.稀释溶液,水解平衡常数增大 |
| B.加入NaOH固体,c(HCO3-)/c(CO32-) 减少 |
| C.升高温度,平衡常数减小 |
| D.通入CO2,pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
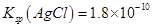 ,
, 。下列关于不溶物之间转化的说法中错误的是:
。下列关于不溶物之间转化的说法中错误的是:A.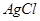 不溶于水,不能转化为 不溶于水,不能转化为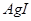 |
B.两种不溶物的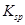 相差越大,不溶物就越容易转化为更难溶的不溶物 相差越大,不溶物就越容易转化为更难溶的不溶物 |
C.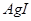 比 比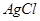 更难溶于水,所以, 更难溶于水,所以,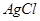 可以转化为 可以转化为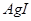 |
D.常温下,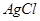 若要在 若要在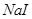 溶液中开始转化为 溶液中开始转化为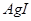 ,则 ,则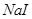 的浓度必须不低于 的浓度必须不低于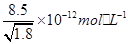 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸钙不溶于水,碳酸钙固体质量不会改变 |
| B.最终会得到碳酸钙的极稀的饱和溶液 |
| C.因为Ca2++CO32-===CaCO3↓很容易发生,不存在CaCO3===Ca2++CO32-的反应 |
| D.因为碳酸钙难溶于水,所以改变外界条件也不会改变碳酸钙的溶解性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com